Разделы сайта
Выбор редакции:
- Явление фазы луны результат затмения
- Толковая библия лопухина - лучшее толкование библии
- Кислотно-щелочной баланс организма – рН
- Известные события произошедшие 12 сентября
- Правила вычисления производных
- Иван III – Государь всея Руси
- Первые металлургические мануфактуры тульского края Где появились первые металлургические заводы
- Формирование ууд на уроках в начальной школе презентация к уроку на тему
- Презентация "герой сталинградской битвы василий григорьевич зайцев"
- Маргинал или изгой общества Кто это такой
Реклама
| Органическая химия: Арены. Арены (ароматические углеводороды) Для аренов наиболее характерны реакции |
|
Химия — очень увлекательная наука. Она изучает все вещества, которые существуют в природе, а их огромное множество. Они разделяются на неорганические и органические. В этой статье мы рассмотрим ароматические углеводороды, которые относятся к последней группе. Что это такое?Это органические вещества, которые имеют в своем составе одно или несколько бензольных ядер — устойчивых структур из шести атомов углерода, соединенных в многоугольник. Данные химические соединения обладают специфическим запахом, что можно понять из их названия. Углеводороды этой группы относятся к циклическим, в отличие от алканов, алкинов и др. Ароматические углеводороды. БензолЭто самое простое химическое соедиение из данной группы веществ. В состав его молекул входят шесть атомов углерода и столько же гидрогена. Все остальные ароматические углеводороды являются производными бензола и могут быть получены с его использованием. Это вещество при нормальных условиях находится в жидком состоянии, оно бесцветное, обладает специфическим сладковатым запахом, в воде не растворяется. Закипать оно начинает при температуре +80 градусов по Цельсию, а замерзать — при +5. Химические свойства бензола и других ароматических углеводородовПервое, на что нужно обратить внимание, — галогенирование и нитрование. Реакции замещенияПервая из них — галогенирование. В этом случае, чтобы химическое взаимодействие могло осуществиться, нужно использовать катализатор, а именно трихлорид железа. Таким образом, если добавить к бензолу (С 6 Н 6) хлор (Cl 2), то мы получим хлорбензол (С 6 Н 5 Cl) и хлороводород (HCl), который выделится в виде прозрачного газа с резким запахом. То есть вследствие этой реакции один атом водорода замещается атомом хлора. То же самое может произойти и при добавлении к бензолу других галогенов (йода, брома и т. д.). Вторая реакция замещения — нитрование — проходит по похожему принципу. Здесь в роли катализатора выступает концентрированный раствор серной кислоты. Для проведения такого рода химической реакции к бензолу необходимо добавить нитратную кислоту (HNO 3), тоже концентрированную, в результате чего образуются нитробензол (C 6 H 5 NO 2) и вода. В этом случае атом гидрогена замещается группой из атома нитрогена и двух оксигена.
Реакции присоединенияЭто второй тип химических взаимодействий, в которые способны вступать ароматические углеводороды. Они также существуют двух видов: галогенирование и гидрирование. Первая происходит только при наличии солнечной энергии, которая выступает в роли катализатора. Для проведения этой реакции к бензолу также необходимо добавить хлор, но в большем количестве, чем для замещения. На одну молекулу бензола должно приходиться три хлора. В результате получим гексахлорциклогексан (С 6 Н 6 Cl 6), то есть к имеющимся атомам присоединится еще и шесть хлора. Гидрирование происходит только в присутствии никеля. Для этого необходимо смешать бензол и гидроген (Н 2). Пропорции те же, что и в предыдущей реакции. Вследствие этого образуется циклогексан (С 6 Н 12). Все остальные ароматические углеводороды также могут вступать в такого типа реакции. Они происходят по такому же принципу, как и в случае с бензолом, только с образованием уже более сложных веществ. Получение химических веществ этой группыНачнем все так же с бензола. Его можно получить с помощью такого реагента, как ацетилен (С 2 Н 2). Из трех молекул данного вещества под воздействием высокой температуры и катализатора образуется одна молекула нужного химического соединения.
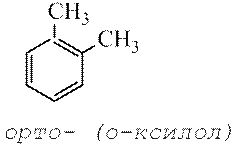
Также бензол и некоторые другие ароматические углеводороды можно добыть из каменноугольной смолы, которая образуется во время производства металлургического кокса. К получаемым таким способом можно отнести толуол, о-ксилол, м-ксилол, фенантрен, нафталин, антрацен, флуорен, хризен, дифенил и другие. Кроме того, вещества этой группы часто добывают из продуктов переработки нефти. Как выглядят разнообразные химические соединения этого класса?Стирол представляет собой бесцветную жидкость с приятным запахом, малорастворимую в воде, температура кипения составляет +145 градусов по Цельсию. Нафталин — кристаллическое вещество, также мало растворяется в воде, плавится при температуре +80 градусов, а закипает при +217. Антрацен в нормальных условиях также представлен в виде кристаллов, однако уже не бесцветных, а имеющих желтую окраску. Это вещество не растворяется ни в воде, ни в органических растворителях. Температура плавления — +216 градусов по шкале Цельсия, кипения — +342. Фенантрен выглядит как блестящие кристалы, которые растворяются только в органических растворителях. Температура плавления — +101 градус, кипения — +340 градусов. Флуорен, как понятно из названия, способен к флуоресценции. Это, как и многие другие вещества данной группы, — бесцветные кристаллы, нерастворимые в воде. Температура плавления — +116, закипания — +294.
Применение ароматических углеводородовБензол используется при производстве красителей в качестве сырья. Также он применяется при получении взрывчатки, пестицидов, некоторых лекарств. Стирол используют в производстве полистирола (пенопласта) с помощью полимеризации исходного вещества. Последний широко применяют в строительстве: в качестве тепло- и звукоизолирующего, электроизоляционного материала. Нафталин, как и бензол, участвует в производстве пестицидов, красителей, лекарств. Кроме того, он используется в химической промышленности для получения многих органических соединений. Антрацен также применяют в изготовлении красителей. Флуорен играет роль стабилизатора полимеров. Фенантрен, как и предыдущее вещество и многие другие ароматические углеводороды, — один из компонентов красителей. Толуол широко применяют в химической промышленности для добывания органических веществ, а также для получения взрывчатки.
Характеристика и использование веществ, добываемых с помощью ароматических углеводородовК таким в первую очередь можно отнести продукты рассмотренных химических реакций бензола. Хлорбензол, к примеру, является органическим растворителем, также используется в производстве фенола, пестицидов, органических веществ. Нитробензол является компонентом полировальных средств для металла, применяется при изготовлении некоторых краситлей и ароматизаторов, может играть роль растворителя и окислителя. Гексахлорциклогексан используется в качестве яда для борьбы с насекомыми-вредителями, а также в химической промышленности. Циклогексан применяют в производстве лакокрасочных изделий, при получении многих органических соединений, в фарамацевтической отрасли промышленности.
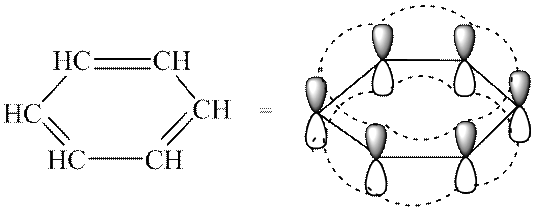
ЗаключениеПрочитав эту статью, можно сделать вывод, что все ароматические углеводороды имеют однотипную химическую структуру, что позволяет объединить их в один класс соединений. Кроме того, их физические и химические свойства также весьма похожи. Внешний вид, температуры кипения и плавления всех химических веществ данной группы не сильно отличаются. Свое применение многие ароматические углеводороды находят в одних и тех же отраслях промышленности. Вещества, которые можно получить вследствие реакций галогенирования, нитрования, гидрирования, также имеют схожие свойства и используются в похожих целях. А РЕНЫ Ароматические углеводороды (арены) – циклические углеводороды, объединяемые понятием ароматичности, которая обуславливает общие признаки в строении и химических свойствах. Классификация По числу бензольных колец в молекуле арены подразделяются на: моноядерные многоядерные
Номенклатура и изомерия Структурным родоначальником углеводородов бензольного ряда служит бензол С 6 Н 6 от которого строятся систематические названия гомологов. Для моноциклических соединений сохраняются следующие несистематические (тривиальные) названия:
Положение заместителей указывают наименьшими цифрами (направление нумерации не имеет значения),
а для ди замещенных соединений можно использовать обозначения орто, мета , пара.
Если в кольце три заместителя тони должны получить наименьшие номера, т.е. ряд «1,2,4» имеет преимущество перед «1,3,4».
1,2-диметил-4-этилбензол (верное название) 3,4-диметил-1-этилбензол (неверно) Изомерия монозамещенных аренов обусловлена строением углеродного скелета заместителя, у ди- и полизамещенных гомологов бензола добавляется ещё изомерия, вызванная различным расположением заместителей в ядре. Изомерия ароматических УВ состава С 9 Н 12:
Физические свойства Температуры кипения и плавления у аренов выше, чем у алканов, алкенов, алкинов, малополярные, не растворимы в воде и хорошо растворимы в неполярных органических растворителях. Арены это жидкости или твердые вещества, имеющие специфические запахи. Бензолы и многие конденсированные арены токсичны, некоторые из них проявляют концерогенные свойства. Промежуточными продуктами окисления конденсированных аренов в организме являются эпоксиды, которые либо сами непосредственно вызывают рак, либо являются предшественниками канцерогенов. Получение аренов Многие ароматические УВ имеют важное практическое значение и производятся в крупном промышленном масштабе. Ряд промышленных способов основан на переработке угля и нефти. Нефть состоит главным образом из алифатических и алициклических УВ, для превращения алифатических или ациклических УВ в ароматические разработаны способы ароматизации нефти, химические основы которых развиты Н.Д. Зелинским, Б.А. Казанским. 1. Циклизация и дегидрирование: 2. Гидродезметилирование:
3. Гомологи бензола получают путем алкилирования или ацилирования с последующим восстановлением карбонильной группы. а) Алкилирование по Фриделю-Крафтсу:
б) Ацилирование по Фриделю-Крафтсу:
4. Получение бифенила по реакции Вюрца-Фитинга: 5. Получение дифенилметана по реакции Фриделя-Крафтса: Строение и химические свойства. Критерии ароматичности: На основании теоретических расчетов и экспериментального изучения циклических сопряженных систем было установлено, что соединение ароматично, если оно имеет:
Что дает ароматичность: Несмотря на высокую степень ненасыщенности, ароматические соединения устойчивы к действию окислителей и температуры, они более склонны вступать в реакции замещения, а не присоединения. Эти соединения обладают повышенной термодинамической стабильностью, обеспечивающейся высокой энергией сопряжения ароматической системы кольца (150 кДж/моль), поэтому арены предпочтительней вступают в реакции замещения, в результате чего сохраняют ароматичность. Механизм реакций электрофильного замещения в ароматическом кольце: Электронная плотность π-сопряженной системы бензольного кольца является удобным объектом для атаки электрофильными реагентами. Как правило, электрофильные реагенты генерируются в процессе реакции при помощи катализаторов и соответствующих условий. Е – Y → E δ + – Y δ - → E + + Y - Образование π-комплекса. Первоначальная атака электрофилом π-электронного облака кольца приводит к координации реагента с π-системой и образованию комплекса донорно-акцепторного типа называемого π-комплекса. Ароматическая система не нарушается:
Образование σ-комплекса. Лимитирующая стадия, на ней электрофил образует ковалентную связь с атомом углерода за счет двух электронов π-системы кольца, что сопровождается переходом данного атома углерода из sp 2 - в sp 3 - гибридное состояние и нарушением ароматической, молекула превращается в карбокатион.
Стабилизация σ-комплекса. Осуществляется путем отщепления от σ-комплекса протона с помощью основания. При этом за счет двух электронов разрывающейся ковалентной связи С – Н восстанавливается замкнутая π-системы кольца, т.е. происходит возврат молекулы в ароматическое состояние:
Влияние заместителей на реакционную способность и ориентацию электрофильного замещения Заместители в бензольном кольце нарушают равномерность в распределении π- электронного облака кольца и тем самым оказывают влияние на реакционную способность кольца.
ПОСОБИЕ-РЕПЕТИТОР ПО ХИМИИ. Арены. Бензол . Статья посвящена ароматическим углеводородам (аренам) и самому простому их представителю – бензолу. Материал содержит к некоторым задачам, – решения. И.В.ТРИГУБЧАК
Ароматические углеводороды (арены). Бензол П л а н 1. Определение, общая форму ла гомологического ряда, строение молекулы (на примере бензола). 2. Физические свойства бензола. 3. Химические свойства бензола: а) реакции замещения (галоге нирование, нитрование, суль фирование, алкилирование); б) реакции присоединения (ги дрирование, хлорирование); в) реакции окисления (горе ние). 4. Получение бензола (в про мышленности – переработкой нефти и угля, дегидрированием циклогексана, ароматизацией гексана, тримеризацией ацетиле на; в лаборатории – сплавлением солей бензойной кислоты со ще лочами). Арены – это углеводороды, молекулы которых содержат одно или несколько бензольных колец. Под бензольным кольцом под разумевается кольцевая система атомов углерода с делокализован ными π-электронами. В 1931 г. Э.Хюккель сформулировал пра вило, гласящее, что соединение должно проявлять ароматические свойства, если в его молекуле со держится плоское кольцо с (4n + 2) обобщенными электронами, где n может проявлять значения целых чисел от 1 и далее (правило Хюк келя). Согласно этому правилу системы, содержащие 6, 10, 14 и т.д. обобщенных электронов, явля ются ароматическими. Различают три группы аренов по количеству и взаимному расположению бен зольных колец. Моноциклические арены. Изобразите структурные фор мулы бензола, толуола, о-ксилола, кумола. Назовите эти вещества по систематической номенклатуре. Полициклические арены с изолированными ядрами. Изобразите структурные фор мулы дифенила, дифенилметана, стильбена.
Изобразите структурные фор мулы нафталина, антрацена.
Общая формула моноциклических аренов ряда бензола – С6Н2n–6, где n ≥ 6. Простейший представитель – бензол (С6Н6). Предложенная в 1865 г. немецким химиком
Радикал, образованный от бензола, имеет тривиальное название фенил.
Физические свойства
При обычных условиях бензол представляет собой бесцветную жидкость с температурой плавления 5,5 °С, температурой кипения 80 °С; имеет характерный запах; легче воды и с ней не смешивается; хороший органический растворитель; токсичен. Химические свойства Химические свойства бензола и его гомологов определяются спецификой ароматической связи. Наиболее характерными для аренов являются реакции замещения (для бензола они протекают тяжелее, чем для его гомологов). Галогенирование.
Нитрование.
Сульфирование.
Алкилирование (реакция Фри деля–Крафтса). Напишите реак
ции получения этилбензола при
взаимодействии бензола с хлор
этаном и с этиленом.
Cистема из 6 π-электронов является более устойчивой, чем 2π-электронная, поэтому реакции присоединения для аренов менее характерны, чем для алкенов; они возможны, но при более жестких условиях. Гидрирование. Напишите реакцию гидрирования бензола до циклогексана.
Присоединение хлора. Напишите реакцию хлорирования бензола до гексахлорана.
Реакции окисления
для бензола возможна только в виде горения, т.к. к действию окислителей бензольное кольцо устойчиво.
Получение аренов |
|
Название |
Формула |
t°.пл., |
t°.кип., |
|
Бензол |
C 6 H 6 |
5,5 |
80,1 |
|
Толуол (метилбензол) |
С 6 Н 5 СH 3 |
95,0 |
110,6 |
|
Этилбензол |
С 6 Н 5 С 2 H 5 |
95,0 |
136,2 |
|
Ксилол (диметилбензол) |
С 6 Н 4 (СH 3) 2 |
||
|
орто- |
25,18 |
144,41 |
|
|
мета- |
47,87 |
139,10 |
|
|
пара- |
13,26 |
138,35 |
|
|
Пропилбензол |
С 6 Н 5 (CH 2) 2 CH 3 |
99,0 |
159,20 |
|
Кумол (изопропилбензол) |
C 6 H 5 CH(CH 3) 2 |
96,0 |
152,39 |
|
Стирол (винилбензол) |
С 6 Н 5 CH=СН 2 |
30,6 |
145,2 |
Бензол – легкокипящая ( t кип = 80,1°С), бесцветная жидкость, не растворяется в воде
Внимание! Бензол – яд, действует на почки, изменяет формулу крови (при длительном воздействии), может нарушать структуру хромосом.
Большинство ароматических углеводородов опасны для жизни, токсичны.
Получение аренов (бензола и его гомологов)
В лаборатории
1. Сплавление солей бензойной кислоты с твёрдыми щелочами
C 6 H 5 -COONa + NaOH t → C 6 H 6 + Na 2 CO 3
бензоат натрия
2. Реакция Вюрца-Фиттинга : (здесь Г – галоген)
С 6 H 5 -Г + 2 Na + R -Г → C 6 H 5 - R + 2 Na Г
С 6 H 5 -Cl + 2Na + CH 3 -Cl → C 6 H 5 -CH 3 + 2NaCl
В промышленности
- выделяют из нефти и угля методом фракционной перегонки, риформингом;
- из каменноугольной смолы и коксового газа
1. Дегидроциклизацией алканов с числом атомов углерода больше 6:
C 6 H 14 t , kat →C 6 H 6 + 4H 2
2. Тримеризация ацетилена (только для бензола) – р. Зелинского :
3С 2 H 2 600° C , акт. уголь →C 6 H 6
3. Дегидрированием циклогексана и его гомологов:
Советский академик Николай Дмитриевич Зелинский установил, что бензол образуется из циклогексана (дегидрирование циклоалканов
C 6 H 12 t, kat →C 6 H 6 + 3H 2

C 6 H 11 -CH 3 t , kat →C 6 H 5 -CH 3 + 3H 2
метилциклогексантолуол
4. Алкилирование бензола (получение гомологов бензола) – р Фриделя-Крафтса .
C 6 H 6 + C 2 H 5 -Cl t, AlCl3 →C 6 H 5 -C 2 H 5 + HCl
хлорэтан этилбензол

Химические свойства аренов
I . РЕАКЦИИ ОКИСЛЕНИЯ
1. Горение (коптящее пламя):
2C 6 H 6 + 15O 2 t →12CO 2 + 6H 2 O + Q
2. Бензол при обычных условиях не обесцвечивает бромную воду и водный раствор марганцовки
3. Гомологи бензола окисляются перманганатом калия (обесцвечивают марганцовку):
А) в кислой среде до бензойной кислоты
При действии на гомологи бензола перманганата калия и других сильных окислителей боковые цепи окисляются. Какой бы сложной ни была цепь заместителя, она разрушается, за исключением a -атома углерода, который окисляется в карбоксильную группу.
Гомологи бензола с одной боковой цепью дают бензойную кислоту:
Гомологи, содержащие две боковые цепи, дают двухосновные кислоты:
5C 6 H 5 -C 2 H 5 + 12KMnO 4 + 18H 2 SO 4 → 5C 6 H 5 COOH + 5CO 2 + 6K 2 SO 4 + 12MnSO 4 +28H 2 O
5C 6 H 5 -CH 3 + 6KMnO 4 + 9H 2 SO 4 → 5C 6 H 5 COOH + 3K 2 SO 4 + 6MnSO 4 +14H 2 O
Упрощённо:
C 6 H 5 -CH 3 + 3O KMnO4 →C 6 H 5 COOH + H 2 O
Б) в нейтральной и слабощелочной до солей бензойной кислоты
C 6 H 5 -CH 3 + 2KMnO 4 → C 6 H 5 COO К + K ОН + 2MnO 2 + H 2 O
II . РЕАКЦИИ ПРИСОЕДИНЕНИЯ (труднее, чем у алкенов)
1. Галогенирование
C 6 H 6 +3Cl 2 h ν → C 6 H 6 Cl 6 (гексахлорциклогексан - гексахлоран)
2. Гидрирование
C 6 H 6 + 3H 2 t , Pt или Ni →C 6 H 12 (циклогексан)
3. Полимеризация
III . РЕАКЦИИ ЗАМЕЩЕНИЯ – ионный механизм(легче, чем у алканов)
б) гомологов бензола при облучении или нагревании
По химическим свойствам алкильные радикалы подобны алканам. Атомы водорода в них замещаются на галоген по свободно-радикальному механизму. Поэтому в отсутствие катализатора при нагревании или УФ-облучении идет радикальная реакция замещения в боковой цепи. Влияние бензольного кольца на алкильные заместители приводит к тому, что замещается всегда атом водорода у атома углерода, непосредственно связанного с бензольным кольцом (a -атома углерода).
1) C 6 H 5 -CH 3 + Cl 2 h ν → C 6 H 5 -CH 2 -Cl + HCl
в) гомологов бензола в присутствии катализатора
C 6 H 5 -CH 3 + Cl 2 AlCl 3 → (смесь орта, пара производных) +HCl
2. Нитрование (с азотной кислотой)
C 6 H 6 + HO-NO 2 t, H2SO4 →C 6 H 5 -NO 2 + H 2 O
нитробензол - запах миндаля !
C 6 H 5 -CH 3 + 3HO-NO 2 t, H2SO4 → С H 3 -C 6 H 2 (NO 2) 3 + 3H 2 O2,4,6-тринитротолуол (тол, тротил)
Применение бензола и его гомологов
Бензол C 6 H 6 – хороший растворитель. Бензол в качестве добавки улучшает качество моторного топлива. Служит сырьем для получения многих ароматических органических соединений – нитробензола C 6 H 5 NO 2 (растворитель, из него получают анилин), хлорбензола C 6 H 5 Cl, фенола C 6 H 5 OH, стирола и т.д.
Толуол C 6 H 5 –CH 3 – растворитель, используется при производстве красителей, лекарственных и взрывчатых веществ (тротил (тол), или 2,4,6-тринитротолуол ТНТ).
Ксилолы C 6 H 4 (CH 3) 2 . Технический ксилол – смесь трех изомеров (орто -, мета - и пара -ксилолов) – применяется в качестве растворителя и исходного продукта для синтеза многих органических соединений.
Изопропилбензол C 6 H 5 –CH(CH 3) 2 служит для получения фенола и ацетона.
Хлорпроизводные бензола используют для защиты растений. Так, продукт замещения в бензоле атомов Н атомами хлора – гексахлорбензол С 6 Сl 6 – фунгицид; его применяют для сухого протравливания семян пшеницы и ржи против твердой головни. Продукт присоединения хлора к бензолу – гексахлорциклогексан (гексахлоран) С 6 Н 6 Сl 6 – инсектицид; его используют для борьбы с вредными насекомыми. Упомянутые вещества относятся к пестицидам – химическим средствам борьбы с микроорганизмами, растениями и животными.
Стирол C 6 H 5 – CH = CH 2 очень легко полимеризуется, образуя полистирол, а сополимеризуясь с бутадиеном – бутадиенстирольные каучуки.
ВИДЕО-ОПЫТЫ
| Читайте: |
|---|
Новое
- Толковая библия лопухина - лучшее толкование библии
- Кислотно-щелочной баланс организма – рН
- Известные события произошедшие 12 сентября
- Правила вычисления производных
- Иван III – Государь всея Руси
- Первые металлургические мануфактуры тульского края Где появились первые металлургические заводы
- Формирование ууд на уроках в начальной школе презентация к уроку на тему
- Презентация "герой сталинградской битвы василий григорьевич зайцев"
- Маргинал или изгой общества Кто это такой
- Студенческие строительные отряды (ссо - вссо) Движение вссо как называли в ссср