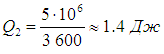Разделы сайта
Выбор редакции:
- Что такое материя и антиматерия?
- Африка полезные ископаемые
- Макс вебер направление или теория
- Десятичные дроби, определения, запись, примеры, действия с десятичными дробями Дроби десятичные числа простоты
- Презентции на тему афганистан, афганская война, скачать бесплатно к классному часу
- Евгений белаш мифы первой мировой
- Что помешало спасти "титаник"
- Конкурсы Английские конкурсы для детей
- Литературно-музыкальная композиция «Есть такая профессия — Родину защищать
- Городской открытый августовский педагогический совет Тематика проведения педсоветов в году
Реклама
| Цикл карно увеличение энтропии. Энтропия. Второе начало термодинамики. Тепловые и холодильные машины. Цикл Карно и его коэффициент полезного действия. Что будем делать с полученным материалом |
|
Лекции по физике. Молекулярная физика и основы термодинамики Второе начало термодинамики. Тепловые двигатели. Энтропия. Цикл Карно Обратимые и необратимые процессы Обратимым называют процесс, допускающий возможность возвращения системы в первоначальное состояние без того, чтобы в окружающей среде остались какие-либо изменения Обратимым может быть лишь равновесный процесс, но не всякий равновесный процесс обратим 2 Обратимые и необратимые процессы Пример. Рассмотрим систему из газа, находящегося в цилиндре под поршнем, на котором установлен груз Уберём груз. Газ расширится. Чтобы вернуть газ в исходное положение надо поднять груз на высоту h, совершив работу A=Mgh, и положить его на поршень Процесс не обратимый М М М М h 3 Обратимые и необратимые процессы Разобьём груз на две равных части Теперь, чтобы расширить и сжать газ в исходное состояние, надо затратить работу A=Mgh/2 Если мы будем производить перемещение поршня на бесконечно малые расстояния, то получим обратимый процесс М/2 h М/2 М/2 М/2 М/2 М/2 М/2 4 Обратимые и необратимые процессы Пример равновесного необратимого процесса – теплообмен Компенсацией за осуществление необратимых круговых процессов является перевод энергии из одной формы в другую. В этом проявляется неэквивалентность различных форм энергии Тепловая энергия оказывается менее ценным видом энергии, чем другие 5 Второе начало термодинамики Второе начало термодинамики констатирует неэквивалентность различных видов энергии. Оно постулирует направление протекания тепловых процессов Формулировка Клаузиуса: Теплота не может самопроизвольно переходить от тела менее нагретого к более нагретому 6 Второе начало термодинамики Формулировка Томсона. Невозможен круговой процесс, единственным результатом которого было бы совершение работы за счёт охлаждения теплового резервуара Устройство, которое позволяло бы осуществлять этот процесс, называется вечным двигателем второго рода 7 Второе начало термодинамики Второе начало Т.Д. накладывает запрет на вечный двигатель второго рода Из второго начала Т.Д. можно получить множество конкретных результатов с помощью метода циклов и метода термодинамических функций 8 Тепловые двигатели Тепловой двигатель – это устройство, в котором совершается циклический Т.Д. процесс В любом тепловом двигателе тепло передаётся от нагревателя к рабочему телу, а затем к холодильнику. При этом совершается полезная работа Нагреватель Q1 Рабочее тело Q2 Холодильник A 9 Тепловые двигатели 10 Метод циклов В циклическом процессе U=0 Q=A=Q1-Q2 При переходе 12 работа совершается системой, а при переходе 21 над системой При переходе 1"2‘ тепло передаётся системе, а при переходе 2"1" от системы КПД теплового двигателя =A/Q1=(Q1-Q2)/Q1 P Адиабаты Q1 2" 1 1" Q2 2 V 11 Цикл Карно Цикл Карно состоит из двух изотерм и двух адиабат Теплоёмкости в адиабатическом и изотермическом процессах не зависят от рабочего тела, поэтому их рассмотрение позволяет выявить ряд общих закономерностей P Адиабаты Изотермы Q1 Т1 Q2 Т2 V 12 Цикл Карно Первая теорема Карно: Коэффициент полезного действия тепловой машины, работающей по циклу Карно, зависит только от температур нагревателя и холодильника и не зависит от устройства машины и типа рабочего тела 13 Цикл Карно Для идеального газа: Q1=RT1ln(V2/V1) Q2=RT2ln(V4/V3) A=Q1-Q2=RT1ln(V2/V1)RT2ln(V3/V4) =A/Q1=/RT1ln(V2/V1) Из уравнения адиабаты: TV-1=const P V1 Q1 Т1 V2 Q2 V4 Т2 V3 V 14 Цикл Карно T1V1-1= T2V4-1 и T1V2-1= T2V3-1 V2/V1=V3/V4 =(T1-T2)/T1=1-T2/T1 Для повышения КПД надо повышать температуру нагревателя и понижать температуру холодильника =(Q1-Q2)Q1=(T1-T2)/T1 Q1/T1=Q2/T2 Величина Q/T называется приведённой теплотой 15 Цикл Карно Вторая теорема Карно: КПД любого цикла не может быть больше, чем КПД цикла Карно - =1Т2/Т1, где под Т1 понимается максимальная, а под Т2 минимальная температура P V 16 Энтропия Рассмотрим произвольный равновесный цикл. Аппроксимируем его малыми циклами Карно Для каждого цикла К можно записать: Q1i/T1i-Q2i/T2i=0 Просуммировав по всем циклам получим: Qk/Tk=0 Т.о. получаем, что dQ/T – дифференциал некоторой Т.Д. функции Назовём эту функцию энтропией P V 17 Энтропия Энтропия – это такая функция состояния, дифференциал которой связан с элементарным тепловым эффектом в обратимом процессе соотношением: dQ=TdS () Энтропия S имеет размерность теплоёмкости С учётом () первое начало Т.Д. можно выразить как: TdS=dU+PdV Отсюда, зная термическое и калорическое уравнения, состояния можно найти зависимость энтропии от Т.Д. параметров 18 Энтропия Найдём энтропию идеального газа Из dU=cVdT и P/T=R/V следует что: dS=cVdT/T+RdV/V S(T,V)=cVlnT+RlnV при cV=const Можно S выразить через T и P: S(T,P)=cPlnT-RlnP 19 Энтропия Определение энтропии через теплоту встречает одну трудность. В точке Т=0 интеграл dQ/T может расходиться Эта неопределённость устраняется постулатом Нернста, называемым иногда третьим началом термодинамики 20 Постулат Нернста Постулат Нернста сводится к двум утверждениям: 1. 2. При приближении к абсолютному нулю энтропия стремится к определённому конечному пределу. Можно положить S(Т=0)=0 Все равновесные процессы при Т=0 происходят без изменения энтропии. В частности, при Т=0 S не зависит от объёма 21 Статистическая интерпретация энтропии Вероятность состояния пропорциональна его статистическому весу Ω, т.е. числу микроскопических способов, которым может быть осуществлено данное макросостояние Разобьём некоторую Т.Д. систему на две подсистемы, которые находятся в состояниях со стат. весами Ω1 и Ω2 Число способов, которыми может реализоваться данное состояние системы: Ω=Ω1Ω2 22 Статистическая интерпретация энтропии Т.о. логарифм стат. веса является аддитивной функцией состояния системы: lnΩ=lnΩ1+lnΩ2 Энтропия системы: S=klnΩ () где k – постоянная Больцмана Формула () называется формулой Больцмана 23 Статистическая интерпретация энтропии Т.к. равновесным состоянием является состояние с наибольшим стат. весом (и наибольшей энтропией), то можно заключить, что при протекании необратимых процессов энтропия изолированной системы возрастает Энтропия системы, находящейся в равновесном состоянии, максимальна 24 Статистическая интерпретация энтропии При протекании обратимых процессов энтропия изолированной системы остаётся постоянной Энтропия равновесной системы не остаётся строго постоянной она претерпевает флуктуации Второй закон термодинамики, иногда называемый законом возрастания энтропии, утверждает, что энтропия изолированной системы может только возрастать либо оставаться неизменной: S≥0 25 26
§6 Энтропия Обычно всякий процесс, при котором система переходит из одного состояния в другое, протекает таким образом, что нельзя провести этот процесс в обратном направлении так, чтобы система проходила через те же промежуточные состояния, и при этом в окружающих телах не произошли какие-либо изменения. Это связано с тем, что в процессе часть энергии рассеивается, например, за счет трения, излучения и т. п. Т. о. практически все процессы в природе необратимы. В любом процессе часть энергии теряется. Для характеристики рассеяния энергии вводится понятие энтропии. (Величина энтропии характеризует тепловое состояние системы и определяет вероятность осуществления данного состояния тела. Чем более вероятно данное состояния, тем больше энтропия.) Все естественные процессы сопровождаются ростом энтропии. Энтропия остается постоянной только в случае идеализированного обратимого процесса, происходящего в замкнутой системе, то есть в системе, в которой не происходит обмен энергией с внешними по отношению к этой системе телами. Энтропия и ее термодинамический смысл: Энтропия - это такая функция состояния системы, бесконечно малое изменение которой в обратимом процессе равно отношению бесконечно малого количества теплоты, введенного в этом процессе, к температуре, при которой оно вводилось. В конечном обратимом процессе изменения энтропии может быть подсчитано по формуле:
где интеграл берется от начального состояния 1 системы до конечного состояния 2. Поскольку энтропия есть функция состояния, то свойством интеграла является его независимость от формы контура (пути), по которому он вычисляется, следовательно, интеграл определяется только начальным и конечным состояниям системы.
(1)
Δ S > 0 (2) Выражения (1) и (2) относятся только к замкнутым системам, если же система обменивается теплотой с внешней средой, то её S может вести себя любым образом. Соотношения (1) и(2) можно представить в виде неравенства Клаузиуса Δ S ≥ 0 т.е. энтропия замкнутой системы может либо возрастать (в случае необратимых процессов) либо оставаться постоянной (в случае обратимых процессов). Если система совершает равновесный переход из состояния 1 в состояния 2, то изменения энтропии
где dU и δA записывается для конкретного процесса. По этой формуле Δ S определяется с точностью до аддитивной постоянной. Физический смысл имеет не сама энтропия, а разность энтропий. Найдем изменение энтропии в процессах идеального газа.
т.е. изменения энтропии S Δ S 1→2 идеального газа при переходе его из состояния 1 в состояния 2 не зависит от вида процесса. Т.к. для адиабатического процесса δ Q = 0, то Δ S = 0 => S = const , то есть адиабатический обратимый процесс протекает при постоянной энтропии. Поэтому его называют изоэнтропийным. При изотермическом процессе (T = const ; T 1 = T 2 : )
При изохорном процессе (V = const ; V 1 = V 2 ; )
Энтропия обладает свойством аддитивности: энтропия системы равна сумме энтропий тел входящих в систему. S = S 1 + S 2 + S 3 + ... Качественным отличием теплового движения молекул от других форм движения является его хаотичность, беспорядочность. Поэтому для характеристики теплового движения необходимо ввести количественную меру степени молекулярного беспорядка. Если рассмотреть какое-либо данное макроскопическое состояния тела с определенными средними значениями параметров, то оно есть нечто иное, как непрерывная смена близких микросостояний, отличающихся друг от друга распределением молекул в разных частях объема и распределяемой энергией между молекулами. Число этих непрерывно сменяющих друг друга микросостояний характеризует степень беспорядочности макроскопического состояния всей системы, w называется термодинамической вероятностью данного микросостояния. Термодинамическая вероятность w состояния системы — это число способов, которыми может быть реализовано данное состояния макроскопической системы, или число микросостояний, осуществляющих данное микросостояния (w ≥ 1, а математическая вероятность ≤ 1 ). За меру неожиданности события условились принимать логарифм его вероятности, взятый со знаком минус: неожиданность состояния равна = - Согласно Больцману, энтропия S системы и термодинамическая вероятность связаны между собой следующим образом: где
- постоянная Больцмана ( Т.к. реальные процессы необратимы, то можно утверждать, что все процессы в замкнутой системе ведут к увеличению ее энтропии - принцип возрастания энтропии. При статистическом толковании энтропии это означает, что процессы в замкнутой системе идут в направлении увеличения числа микросостояний, иными словами, от менее вероятных состояний к более вероятным, до тех пор, пока вероятность состояния не станет максимальной. §7 Второе начало термодинамики Первое начало термодинамики, выражая закон сохранения энергии и превращения энергии, не позволяет установить направление протекания т/д процессов. Кроме того, можно представить множество процессов, не противоречащих I началу т/д, в которых энергия сохраняется, а в природе они не осуществляются. Возможные формулировки второго начало т/д: 1) закон возрастания энтропии замкнутой системы при необратимых процессах: любой необратимой процесс в замкнутой системе происходит так, что энтропия системы при этом возрастает Δ S ≥ 0 (необратимый процесс) 2) Δ S ≥ 0 (S = 0 при обратимом и Δ S ≥ 0 при необратимом процессе) В процессах, происходящих в замкнутой системе, энтропия не убывает. 2) Из формулы Больцмана S = , следовательно, возрастание энтропии означает переход системы из менее вероятного состояния в более вероятное. 3) По Кельвину: не возможен круговой процесс, единственным результатом которого является превращения теплоты, полученной от нагревателя в эквивалентную ей работу. 4) По Клаузиусу: не возможен круговой процесс, единственным результатом которого является передача теплоты от менее нагретого тела к более нагретому. Для описания т/д систем при 0 К используют теорему Нернста-Планка (третье начало т/д): энтропия всех тел в состоянии равновесия стремится к нулю по мере приближения температуры к 0 К Из теоремы Нернста-Планка следует, что C p = C v = 0 при 0 К §8 Тепловые и холодильные машины. Цикл Карно и его к.п.д. Из формулировки второго начала т/д по Кельвину следует, что вечный двигатель второго рода невозможен. (Вечный двигатель - это периодически действующий двигатель, совершающий работу за счет охлаждения одного источника теплоты.)
Принцип действия теплового двигателя: от термостата с температурой Т 1 - нагревателя, за цикл отнимается количество теплоты Q 1 , а термостату с температурой Т 2 (Т 2 < Т 1) -холодильнику, за цикл передается количество теплоты Q 2 , при этом совершается работа А = Q 1 - Q 2
Прямой цикл используется в тепловых двигателях - периодически действующих двигателях, совершающих работу за счет полученной извне теплоты. Обратный цикл используется в холодильных машинах - периодически действующих установках, в которых за счет работы внешних сил теплота переносится к телу с более высокой температурой. В результате кругового процесса система возвращается в исходное состояние и, следовательно, полное изменение внутренней энергии равно нулю. Тогда І начало т/д для кругового процесса Q = Δ U + A = A , Т. е. работа, совершаемая за цикл равна количеству полученной извне теплоты, но Q = Q 1 - Q 2 Q 1 - количество теплоты, полученное системой, Q 2 - количество теплоты, отданное системой. Термический к.п.д. для кругового процесса равен отношению работы, совершенной системой, к количеству теплоты, подведенному к системе:
Чтобы η = 1, должно выполняться условие Q 2 = 0, т.е. тепловой двигатель должен иметь один источник теплоты Q 1 , но это противоречит второму началу т/д. Процесс обратный происходящему в тепловом двигателе, используется в холодильной машине.
Q = Q 2 - Q 1 < 0, следовательно A < 0. Без совершения работы нельзя отбирать теплоту от менее нагретого тела и отдавать ее более нагретому. Основываясь на втором начале т/д, Карно вывел теорему. Теорема Карно: из всех периодически действующих тепловых машин, имеющих одинаковые температуры нагревателей (Т 1) и холодильников (Т 2), наибольшим к.п.д. обладают обратимые машины. К.П.Д. обратимых машин при равных Т 1 и Т 2 равны и не зависят от природы рабочего тела. Рабочее тело - тело, совершающее круговой процесс и обменивающиеся энергией с другими телами. Цикл Карно - обратимый наиболее экономичный цикл, состоящий из 2-х изотерм и 2-х адиабат.
2-3 - адиабат. расширение, газ совершает работу A 2-3 >0 над внешними телами. 3-4-изотермическое сжатие при Т
2 холодильника; отбирается теплота
Q
2
и совершается работа
4-1-адиабатическое сжатие, над газом совершается работа A 4-1 <0 внешними телами. При изотермическом процессе U = const , поэтому Q 1 = A 12
При адиабатическом расширении Q 2-3 = 0, и работа газа A 23 совершается за счет внутренней энергии A 23 = - U
Количество теплоты Q 2 , отданное газом холодильнику при изотермическом сжатии равно работе сжатия А 3-4
Работа адиабатического сжатия
Работа, совершаемая в результате кругового процесса A = A 12 + A 23 + A 34 + A 41 = Q 1 + A 23 - Q 2 - A 23 = Q 1 - Q 2 и равна площади кривой 1-2-3-4-1. Термический к.п.д. цикла Карно
Из уравнения адиабаты для процессов 2-3 и 3-4 получим Тогда
т.е. к.п.д. цикла Карно определяется только температурами нагревателя и холодильника. Для увеличения к.п.д. нужно увеличивать разность Т 1 - Т 2 . ******************************************************* ****************************************************** Второе начало термодинамики. Принцип работы тепловой машины. Цикл Карно. КПД теплового двигателя. Второе начало термодинамики (ВНТ) Выражая всеобщий закон сохранения и превращения энергии, первое начало термодинамики (ПНТ) не позволяет определить направление протекания процессов ВНТ справедливо только по отношению к термодинамическим системам. Существует несколько эквивалентных формулировок ВНТ: 1. Невозможен процесс, единственным результатом которого является передача теплоты от холодного тела к горячему (формулировка Клаузиуса). 2. Невозможен процесс, единственным результатом которого является совершение работы за счёт охлаждения одного тела (формулировка Томсон). 3. Энтропия изолированной системы не может убывать при любых происходящих в ней процессах, ᴛ.ᴇ. dS³0, где знак равенства относится к обратимым процессам, а знак больше – к необратимым процессам.(Формулировка Клаузиуса) Формула Больцмана (31) S=klnW позволяет дать статистическое истолкование третьей формулировки ВНТ: Термодинамическая вероятность W состояния изолированной системы при всех происходящих в ней процессах не может убывать. Оно выражает необходимые закономерности хаотического движения большого числа частиц, входящих в состав изолированной системы. Цикл Карно Цикл Карно изображен, где изотермическое расширение и сжатие заданы соответственно кривыми 1-2 и 3-4, адиабатическое расширение и сжатие – кривыми 2-3 и 4-1. Принцип работы тепловой машины. Тепловой машиной принято называть циклическое устройство, превращающее теплоту, выделенную при сжигании топлива, в работу. Элементы тепловой машины: Нагреватель Рабочее вещество Холодильник На примере цилиндра автомобиля - происходит нагревание воздуха, повышение температуры воздуха, это вызывает поступательное движение поршня. Движущийся поршень приводит во вращение коленчатый вал, а далее через систему зубчатых передач вращательное движение передаётся колёсам. КПД-Это работы машины к затраченной энергии. Для работы любой тепловой машины по замкнутому циклу необходима внешняя среда, которую условно можно представить себе как два тела - нагреватель Т mах, и холодильник , находящийся при температуре T min (T min < Т mах ). Предполагается, что при контакте с нашей системой температуры нагревателя и холодильника не меняются. При контакте с нагревателем система получает тепло, при контакте с холодильником - отдает его. В термодинамике существует теорема Карно (рис. 5.2): Рис. 5.2. Леонар Сади Карно (французский физик и военный инженер)
Реализация максимально возможного КПД достигается в так называемом цикле Карно , когда идеальный газ проходит замкнутый цикл, составленный из двух адиабат и двух изотерм (рис. 5.3).
Рис. 5.3. Цикл Карно (обходится по часовой стрелке) - комбинация двух изотерм 1 - 2, 3 - 4 и двух адиабат 2 - 3 и 4 - 1 ; теплообмен со средой осуществляется на изотермических участках цикла: на участке 1 - 2 газ получает теплоту Q 1 , а на участке 3 - 4 отдает теплоту Q 2 Убедимся, что показанный замкнутый процесс действительно имеет КПД, соответствующий формуле (5.5). Температура системы равна T 1 в точках 1, 2 и T 2 в точках 3, 4 . Значения остальных термодинамических параметров (р, V) будут иметь в качестве индекса номер соответствующей точки на диаграмме. Нам надо вычислить количества полученной Q 1 , и отданной Q 2 теплоты, найти совершенную газом работу А Ц = Q 1 – Q 2 и определить КПД цикла. Сразу заметим, что на участках 2-3 и 4-1 система не обменивается теплом с внешней средой. Следовательно, теплоту Q 1 газ получает на участке 1-2, а теплоту Q 2 отдает на участке 3-4. Рассмотрим подробнее различные участки цикла. Изотерма 1 -2. На этом участке газ находится в контакте с нагревателем и происходит изотермическое расширение от объема V 1 до объема V 2 . Температура Т 1 не меняется, следовательно, не изменяется внутренняя энергия, а вся полученная теплота расходуется на совершение газом работы:
Величину работы газа при изотермическом процессе мы уже вычисляли ранее, так что с учетом формулы (2.13)
Адиабата 2 -3. Здесь система отсоединяется от нагревателя и не обменивается теплом с внешней средой: Q 23 = 0 . Газ продолжает расширяться, но уже адиабатно. Работа совершается за счет внутренней энергии газа, и его температура падает до значения Т 2 . На этом участке цикла нам нужна информация, доставляемая уравнением адиабаты :
Изотерма 3 -4. Система подключается к холодильнику, и газ начинает сжиматься. Внутренняя энергия остается неизменной, над газом совершается работа (А 34 < 0 ), а выделяющееся
передается холодильнику. Имеем аналогично (5.6)
Адиабата 4 -1. Система отключена от внешней среды и продолжает сжиматься изотермически, что приводит к повышению ее температуры до Т 1 . В конечном итоге система возвращается в первоначальное состояние. Поскольку точки 4 и 1 лежат на адиабате, получаем связь объемов и температур, аналогичную (5.7):
Из уравнений (5.7) и (5.9) находим отношения объемов
откуда следует, что Поэтому отдаваемую холодильнику теплоту Q 2 (см. уравнение (5.8)) можно записать как
Используя выражение (5.6) для теплоты, полученной системой, находим совершенную в ходе цикла работу
Из проведенного анализа следует также, что максимальная температура в цикле равна Т mах = Т 1 , а минимальная - Т min = Т 2 . Если разделить (5.12) на (5.6), то немедленно получим выражение (5.5) для КПД цикла Карно, из которого выпадают все параметры, кроме температур холодильника и нагревателя. Пример 1. Котел тепловой станции работает при температуре около t 1 = 550 °С . Отработанное тепло отводится к реке при температуре около t 2 = 20 °С . Найдем максимально возможный КПД этой станции (рис. 5.4).
Рис. 5.4. Схема работы тепловой машины Карно Поскольку в формуле для КПД цикла Карно используются абсолютные температуры, надо перейти от шкалы Цельсия к шкале Кельвина: Т 1 = 550 + 273 = 823 К , Т 2 = 20 + 273 = 293 К . Теперь находим КПД тепловой станции:
Конечно, реальный КПД станции заметно ниже. Если цикл Карно осуществить в обратном направлении, то есть против часовой стрелки на рис. 5.2, то для определения эффективности холодильной установки надо использовать формулы (5.3), (5.4) и выражения (5.6), (5.11). Получаем тогда
Печально, но чем ниже температура внешней среды Т 1 , тем меньше мы нуждаемся в холодильнике, и тем эффективнее он работает.
Рис. 5.5. Схема работы холодильной установки Приведем численный пример. Если кондиционер поддерживает в комнате температуру t 2 = 20 °С , а температура наружного воздуха равна t 1 = 30 °С , то для холодильного коэффициента имеем
а для КПД холодильника
Конечно, на самом деле температура тепловыделяющего элемента больше наружной температуры на 20–30 градусов, так что разность температур может достигать 30–40 градусов, что приводит к значениям
Напомним, что речь идет об идеальных установках, работающих по циклу Карно. Реальный типичный кондиционер потребляет мощность 750 Вт , перекачивая за час около 5 МДж тепловой энергии. Это значит, что за секунду кондиционер совершает работу А = 750 Дж и отнимает у воздуха в комнате теплоту
Отсюда находим Мы видим, что реальный кондиционер гораздо менее эффективен, нежели идеальный холодильник Карно. Пример 2. Пусть в домашнем холодильнике поддерживается температура t 2 = –3 °С (Т 2 = 270 К ), а температура в кухне равна t 1 = 27 °С (T 1 = 300 К ). Пусть далее мотор холодильника потребляет мощность N = 200 Вт . Предполагая, что холодильник работает по циклу Карно и что тепловыделяющий элемент имеет температуру окружающего воздуха, определим мощность потока тепловой энергии, перекачиваемой из камеры холодильника в кухню. За время t мотор совершит работу КПД холодильника равен
откуда находим количество теплоты, поступающее в кухню в единицу времени:
Обратите внимание, что холодильник работает как весьма эффективный обогреватель помещения. Надо только оплачивать потребляемую мотором мощность 200 Вт , а в кухню поступит в 10 раз большая энергия, 90 % которой перекачивается из камеры холодильника (90 % - КПД холодильника в этом примере). Любопытно, что если бы вместо холодильника был включен обогреватель той же мощности, то он нагревал бы помещение в 10 раз слабее. Наши численные оценки можно рассматривать как пример теплового загрязнения окружающей среды, свойственного технической цивилизации. Дополнительная информация http://eqworld.ipmnet.ru/ru/library/physics/thermodynamics.htm - Я. де Бур Введение в молекулярную физику и термодинамику, Изд. ИЛ, 1962 г. - стр. 202–205, ч. 2, гл. 2, § 10: описан процесс ожижения газа Клода - Гейландта. |
| Читайте: |
|---|
Популярное:
Новое
- Африка полезные ископаемые
- Макс вебер направление или теория
- Десятичные дроби, определения, запись, примеры, действия с десятичными дробями Дроби десятичные числа простоты
- Презентции на тему афганистан, афганская война, скачать бесплатно к классному часу
- Евгений белаш мифы первой мировой
- Что помешало спасти "титаник"
- Конкурсы Английские конкурсы для детей
- Литературно-музыкальная композиция «Есть такая профессия — Родину защищать
- Городской открытый августовский педагогический совет Тематика проведения педсоветов в году
- Примеры стилей текста: калейдоскоп вариаций речи

 Равновесное состояние термодинамической системы определяется постоянством значений макроскопических величин, характеризующих это состояние. Обратимым называют такой термодинамический процесс А→B, который, будучи проведен в
Равновесное состояние термодинамической системы определяется постоянством значений макроскопических величин, характеризующих это состояние. Обратимым называют такой термодинамический процесс А→B, который, будучи проведен в  Цикл Карно Садди Карно 1796 -1832 Франция. Тело отдает тепло→ знак изменится на “-” η- всех обратимых систем, работающих в идентичных условиях одинаков и определяется только температурами нагревателя и холодильника. T 1 4 2 3 S
Цикл Карно Садди Карно 1796 -1832 Франция. Тело отдает тепло→ знак изменится на “-” η- всех обратимых систем, работающих в идентичных условиях одинаков и определяется только температурами нагревателя и холодильника. T 1 4 2 3 S При необратимом адиабатическом процессе энтропия возрастает η-любой необратимой машины всегда меньше, чем η обратимой, работающей в тех же условиях. Тепловая машина. 1 2 4 3
При необратимом адиабатическом процессе энтропия возрастает η-любой необратимой машины всегда меньше, чем η обратимой, работающей в тех же условиях. Тепловая машина. 1 2 4 3 Предвестники 2 -ого начала термодинамики. Нельзя ли построить периодически действующую тепловую машину без холодильника? . Q 2=0 => такая машина превращала бы в работу всю теплоту, заимствованную от нагревателя. Закон сохранения энергии здесь не нарушается. Тогда представляется возможность создания вечного двигателя 2 -го рода (перпетуум мобиле 2 -го рода) => Заимствуем тепло из «неограниченного» (из океана, атмосферы, недров Земли) источника и превращаем его в работу. … тепло и вечный двигатель => Вильгельм Оствальд (1853 -1932 гг.)
Предвестники 2 -ого начала термодинамики. Нельзя ли построить периодически действующую тепловую машину без холодильника? . Q 2=0 => такая машина превращала бы в работу всю теплоту, заимствованную от нагревателя. Закон сохранения энергии здесь не нарушается. Тогда представляется возможность создания вечного двигателя 2 -го рода (перпетуум мобиле 2 -го рода) => Заимствуем тепло из «неограниченного» (из океана, атмосферы, недров Земли) источника и превращаем его в работу. … тепло и вечный двигатель => Вильгельм Оствальд (1853 -1932 гг.) Возможность совершения работы тепловыми двигателями обусловлена переходом тепла от тела более нагретому к телу менее нагретому.
Возможность совершения работы тепловыми двигателями обусловлена переходом тепла от тела более нагретому к телу менее нагретому.



 Энтропия, а для -приведенная теплота, является Но отношение функцией состояния системы - энтропия, где S- параметр состояния(как и P, V, T) В замкнутой или изолированной системе при протекании любого обратимого процесса энтропия остается неизменной
Энтропия, а для -приведенная теплота, является Но отношение функцией состояния системы - энтропия, где S- параметр состояния(как и P, V, T) В замкнутой или изолированной системе при протекании любого обратимого процесса энтропия остается неизменной При протекании в замкнутой термодинамической системе необратимого процесса, энтропия системы возрастает, достигая своего максимума в состоянии равновесия системы. Если, то какие либо изменения в системе без внешнего воздействия невозможны. - для обратимого процесса - для необратимого процесса Энтропия-мера отклонения реального процесса от идеального.
При протекании в замкнутой термодинамической системе необратимого процесса, энтропия системы возрастает, достигая своего максимума в состоянии равновесия системы. Если, то какие либо изменения в системе без внешнего воздействия невозможны. - для обратимого процесса - для необратимого процесса Энтропия-мера отклонения реального процесса от идеального. I-начало: II-начало: В замкнутой или изолированной системе при протекании необратим процесса энтропия системы возрастает, достигая своего максимума в состоянии равновесия системы. Если система находится в состоянии равновесия то какие либо изменения в системе без внешнего воздействия невозможны. Энтропия замкнутой системы может только возрастать. 1. Устанавливает наличие в природе фундаментальной асимметрии – однонаправленность всех самопроизвольно происходящих в природе процессов. 2. Количество энергии в замкнутых системах сохраняется, но распределение энергии меняется необратимым образом. III-начало: Если Т→ 0, то S→ 0, т. е. невозможно охладить вещество до температуры абсолютного нуля.
I-начало: II-начало: В замкнутой или изолированной системе при протекании необратим процесса энтропия системы возрастает, достигая своего максимума в состоянии равновесия системы. Если система находится в состоянии равновесия то какие либо изменения в системе без внешнего воздействия невозможны. Энтропия замкнутой системы может только возрастать. 1. Устанавливает наличие в природе фундаментальной асимметрии – однонаправленность всех самопроизвольно происходящих в природе процессов. 2. Количество энергии в замкнутых системах сохраняется, но распределение энергии меняется необратимым образом. III-начало: Если Т→ 0, то S→ 0, т. е. невозможно охладить вещество до температуры абсолютного нуля.
 - МАЛО! У реальных
- МАЛО! У реальных 2. Клаузиус (1822 – 1888) в 1850 “ Теплота не может самопроизвольно переходить от тела менее нагретого к телу более нагретому. ” Вообще “она” возможна. Но она невозможна при условии, что во всех остальных телах не произошло никаких изменений. Холодильник, но процесс не самопроизвольный, а сопровождается работой электрического мотора. 3. т. Нернста: энтропия любого тела стремится к нулю при Т → 0 Обратимый процесс - процесс, при котором система переходит из состояния А в В и возможно вернуть ее хотя бы одним способом в исходное состояние А и при том так, чтобы во всех остальных телах не произошло никаких изменений.
2. Клаузиус (1822 – 1888) в 1850 “ Теплота не может самопроизвольно переходить от тела менее нагретого к телу более нагретому. ” Вообще “она” возможна. Но она невозможна при условии, что во всех остальных телах не произошло никаких изменений. Холодильник, но процесс не самопроизвольный, а сопровождается работой электрического мотора. 3. т. Нернста: энтропия любого тела стремится к нулю при Т → 0 Обратимый процесс - процесс, при котором система переходит из состояния А в В и возможно вернуть ее хотя бы одним способом в исходное состояние А и при том так, чтобы во всех остальных телах не произошло никаких изменений. Второе начало термодинамики. Направление термодинамических процессов в изолированной системе → к состояниям, вероятность которых максимальна: --Теплопередача => выравнивание температур. --Диффузия => однородный газ не может собраться в одной половинке сосуда. Энтропия. Статистический вес - число различных микросостояний, посредством которых осуществляется данное макросостояние w; Все макросостояния равновесны => вероятность макросостояния пропорциональна его статистическому весу. – энтропия – характеризует вероятность состояния термодинамической системы.
Второе начало термодинамики. Направление термодинамических процессов в изолированной системе → к состояниям, вероятность которых максимальна: --Теплопередача => выравнивание температур. --Диффузия => однородный газ не может собраться в одной половинке сосуда. Энтропия. Статистический вес - число различных микросостояний, посредством которых осуществляется данное макросостояние w; Все макросостояния равновесны => вероятность макросостояния пропорциональна его статистическому весу. – энтропия – характеризует вероятность состояния термодинамической системы. Невозможность вечного двигателя 2 -ого рода. Молекулы сами собрались в ½ части сосуда и, затем, за счет подводимого тепла изотермически расширяясь совершают работу: Вроде бы все хорошо, если бы молекулы действительно циклически собирались самопроизвольно в ½ части объема сосуда. А вот у тепловой машины энтропия возрастает! но т. к. , то
Невозможность вечного двигателя 2 -ого рода. Молекулы сами собрались в ½ части сосуда и, затем, за счет подводимого тепла изотермически расширяясь совершают работу: Вроде бы все хорошо, если бы молекулы действительно циклически собирались самопроизвольно в ½ части объема сосуда. А вот у тепловой машины энтропия возрастает! но т. к. , то Связь энтропии с вероятностью. Всякий процесс в природе протекает так, что система переходит в состояние, вероятность которого больше. Если система находится в состоянии с данной энтропией, то с подавляющей вероятностью следует ожидать, что она перейдет в состояние с большей энтропией, т. е. что наиболее вероятным изменением энтропии является ее возрастание. Но возможны и процессы с уменьшением энтропии – флуктуации ω в среднем росте.
Связь энтропии с вероятностью. Всякий процесс в природе протекает так, что система переходит в состояние, вероятность которого больше. Если система находится в состоянии с данной энтропией, то с подавляющей вероятностью следует ожидать, что она перейдет в состояние с большей энтропией, т. е. что наиболее вероятным изменением энтропии является ее возрастание. Но возможны и процессы с уменьшением энтропии – флуктуации ω в среднем росте.