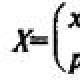Разделы сайта
Выбор редакции:
- Маргинал или изгой общества Кто это такой
- Студенческие строительные отряды (ссо - вссо) Движение вссо как называли в ссср
- Целебные свойства марганцовки — полезные советы
- Подготовка к егэ по обществознанию
- Гитлер в «Mein Kampf»: «Русские – великий народ» - aquilaaquilonis
- Бои на Халхин-Голе (1939)
- Умножение на однозначное число столбиком
- Методическая разработка семинара для педагогов дополнительного образования на тему «Создание развивающей образовательной среды для обучающихся на занятиях
- Ноев ковчег. Ковчег спасения. Значение «ноев ковчег Что означает фразеологизм ноев ковчег
- Презентация по физике на тему "звуковые волны"
Реклама
| Молекулы виды связей в молекулах молекулярные спектры. Строение и спектры молекул. Химические связи и строение молекул |
|
Спектром называется последовательность квантов энергии электромагнитного излучения, поглощенных, выделившихся, рассеянных или отраженных веществом при переходах атомов и молекул из одних энергетических состояний в другие. В зависимости от характера взаимодействия света с веществом спектры можно разделить на спектры поглощения (абсорбционные); испускания (эмиссионные); рассеяния и отражения. По изучаемым объектам оптическая спектроскопия, т.е. спектроскопия в области длин волн 10 -3 ÷10 -8 м подразделяется на атомную и молекулярную. Атомный спектр представляет собой последовательность линий, положение которых определяется энергией перехода электронов с одних уровней на другие. Энергию атома можно представить как сумму кинетической энергии поступательного движения и электронной энергии : где - частота, - длина волны, - волновое число, - скорость света, - постоянная Планка. Так как энергия электрона в атоме обратно пропорциональна квадрату главного квантового числа , то для линии в атомном спектре можно записать уравнение:
Здесь Все линии атомного спектра сходятся в коротковолновой области к пределу, определенному энергией ионизации атома, после которого идет сплошной спектр. Энергию молекулы в первом приближении можно рассмотреть как сумму поступательной, вращательной, колебательной и электронной энергий:
Для большинства молекул такое условие выполняется. Например, для Н 2 при 291К отдельные составляющие полной энергии различаются на порядок и более: 309,5 кДж/моль,
2,5 кДж/моль,
Значения энергии квантов в различных областях спектра сопоставлены в таблице 4.2. Таблица 4.2 - Энергия поглощенных квантов различных областей оптического спектра молекул Понятия «колебания ядер» и «вращение молекул» являются условными. В действительности такие виды движения лишь очень приближенно передают представления о распределении ядер в пространстве, которое носит такой же вероятностный характер, что и распределение электронов. Схематичная система уровней энергии в случае двухатомной молекулы представлена на рисунке 4.1. Переходы между вращательными уровнями энергии приводит к появлению вращательных спектров в дальней ИК и микроволновой областях. Переходы между колебательными уровнями в пределах одного электронного уровня дают колебательно-вращательные спектры в ближней ИК области, поскольку изменение колебательного квантового числа неминуемо влечет за собой изменение и вращательного квантового числа . Наконец, переходы между электронными уровнями вызывают появление в видимой и УФ областях электронно-колебательно-вращательных спектров. В общем случае число переходов может быть очень велико, но на самом деле в спектрах проявляются далеко не все. Количество переходов ограничено правилами отбора . Молекулярные спектры дают богатую информацию. Они могут быть использованы: Для идентификации веществ в качественном анализе, т.к. каждое вещество имеет свой собственный только ему присущий спектр; Для количественного анализа; Для структурно-группового анализа, поскольку определенные группы, такие, например, как >С=О, _ NH 2 , _ OH и др. дают в спектрах характеристические полосы; Для определения энергетических состояний молекул и молекулярных характеристик (межъядерное расстояние, момент инерции, собственные частоты колебаний, энергии диссоциации); комплексное изучение молекулярных спектров позволяет сделать выводы о пространственном строении молекул; В кинетических исследованиях, в том числе для изучения очень быстрых реакций.
Энергии колебательных уровней; Энергии вращательныхуровней Рисунок 4.1 – Схематичное расположение уровней энергии двухатомной молекулы Закон Бугера-Ламберта-Бера В основе количественного молекулярного анализа с использованием молекулярной спектроскопии лежит закон Бугера-Ламберта-Бера , связывающий интенсивность света падающего и прошедшего с концентрацией и толщиной поглощающего слоя (рисунок 4.2): или с коэффициентом пропорциональности: Результат интегрирования:
При уменьшении интенсивности падающего света на порядок
Если =1 моль/л, то , т.е. коэффициент поглощения равен обратной толщине слоя, в котором при концентрации, равной 1, интенсивность падающего света уменьшается на порядок. Коэффициенты поглощения и зависят от длины волны. Вид этой зависимости является своеобразным «отпечатком пальцев» молекул, что используется в качественном анализе для идентификации вещества. Эта зависимость характерна и индивидуальна для того или иного вещества и отражает характеристические группы и связи, входящие в молекулу. Оптическая плотность D выражаемое в % 4.2.3 Энергия вращения двухатомной молекулы в приближении жесткого ротатора. Вращательные спектры молекул и их применение для определения молекулярных характеристик Появление вращательных спектров связано с тем, что вращательная энергия молекулы квантуется, т.е.
Поскольку точкаO является центром тяжести молекулы, то: Введение обозначения приведенной массы :
приводит к уравнению
Таким образом, двухатомную молекулу (рисунок 4.7а ), вращающуюся вокруг оси или , проходящей через центр тяжести, можно упрощенно рассматривать как частицу с массой , описывающую круг с радиусом вокруг точкиO (рисунок 4.7б ). Вращение молекулы вокруг оси дает момент инерции, практически равный нулю, поскольку радиусы атомов значительно меньше межъядерного расстояния. Вращениеотносительно осей или , взаимно перпендикулярных линии связи молекулы, приводит к равным по величине моментам инерции: где - вращательное квантовое число, принимающее только целочисленные значения 0, 1, 2…. В соответствии с правилом отбора для вращательного спектра двухатомной молекулы изменение вращательного квантового числа при поглощении кванта энергии возможно лишь на единицу, т.е. преобразует уравнение (4.37) в вид:
волновое число линии во вращательном спектре, соответствующей поглощению кванта при переходе с j уровня энергии на уровень j +1, можно вычислить по уравнению: Таким образом, вращательный спектр в приближении модели жесткого ротатора представляет собой систему линий, находящихся на одном и том же расстоянии друг от друга (рисунок 4.5б). Примеры вращательных спектров двухатомных молекул, оцененных в моделижесткий ротатор, представлены на рисунке 4.6.

Рисунок 4.6 – Вращательныe спектры HF (а ) иCO (б ) Для молекул галогеноводородов этот спектр смещен в дальнюю ИК область спектра, для более тяжелых молекул – в микроволновую. Исходя из полученных закономерностей возникновения вращательного спектра двухатомной молекулы, на практике сперва определяют расстояние между соседними линиями в спектре , из которого далее находят , и по уравнениям:
где - постоянная центробежного искажения
, связана с вращательной постоянной примерным соотношением Для многоатомных молекул в общем случае возможно существование трех разных моментов инерции где Для вычисления величины изотопного сдвига линии необходимо последовательно рассчитать приведенную массу изотопозамещенной молекулы с учетом изменения атомной массы изотопа, момент инерции , вращательную постоянную и положение линии в спектре молекулы по уравнениям (4.34), (4.35), (4.39) и (4.43), соответственно, или оценить отношение волновых чисел линий, отвечающих одному и тому же переходу в изотопозамещенной и неизотопозамещенной молекулах, и далее определить направление и величину изотопного сдвига по уравнению (4.50). Если межъядерное расстояние приближенно считать постоянным где - общее число частиц, - число частиц наi - том уровне энергии при температуре T , k – постоянная Больцмана, - статистический ве сили степень вырождения i -того уровня энергии, характеризует вероятность нахождения частиц на данном уровне. Для вращательного состояния заселенность уровня характеризуют обычно отношением числа частицнаj - том уровне энергии к числу частиц на нулевом уровне :
где Экстремум функции соответствует уровню с максимальной относительной заселенностью, значение квантового числа которого можно вычислить по уравнению, полученному после определения производной функции в экстремуме:
Рисунок 4.7 – Относительная заселенность вращательных уровней энергии молекулыCO при температурах 298 и 1000 К Пример.
Во вращательном спектреHI определено расстояние между соседними линиями Решение В приближении модели жесткого ротатора в соответствии с уравнением (4.45) определяем вращательную постоянную:
Момент инерции молекулы вычисляем из значения вращательной постоянной по уравнению (4.46):
Для определения равновесного межъядерного расстоянияиспользуем уравнение (4.47), учитывая, что массы ядер водорода Пример. В дальней ИК-области спектра 1 H 35 Cl обнаружены линии, волновые числа которых: Определите усредненные значения момента инерции и межъядерного расстояния молекулы. Отнесите наблюдаемые линии в спектре к вращательным переходам. Решение Согласно модели жесткого ротатора разность волновых чисел соседних линий вращательного спектра постоянна и равна 2 . Определим вращательную постоянную по среднему значению расстояний между соседними линиями в спектре:
Находим момент инерции молекулы (уравнение (4.46)): Рассчитываем равновесное межъядерное расстояние (уравнение (4.47)), принимая во внимание, что массы ядер водорода По уравнению (4.43) оцениваем положение линий во вращательном спектре 1 H 35 Cl: Соотносим рассчитанные значения волновых чисел линий с экспериментальными. Получается, что наблюдаемые во вращательном спектре 1 H 35 Cl линии соответствуют переходам:
Пример.
Определите величину и направление изотопного сдвига линии поглощения, отвечающей переходу с Решение Для определения величины изотопного сдвига линии, отвечающей переходу далее вычисляем момент инерции , вращательную постоянную и положение линии Иначеизотопный сдвиг можно оценитьиз отношения волновых чисел линий, отвечающих одному и тому же переходу в молекулах, (межъядерное расстояние считаем постоянным) и далее положение линии в спектре, используя уравнение (4.51). Для молекул 1 H 35 Cl и 1 H 37 Cl отношение волновых чисел заданного перехода равно:
Для определения волнового числа линии изотопозамещенной молекулы подставляем найденное в предыдущем примере значение волнового числа перехода j → j +1 (3→4): Делаем вывод: изотопный сдвиг в низкочастотную или длинноволновую область составляет 85.384-83.049=2.335 см -1 . Пример. Рассчитайте волновое число и длину волны наиболее интенсивной спектральной линии вращательного спектра молекулы 1 H 35 Cl. Соотнесите линию с соответствующим вращательным переходом. Решение Наиболее интенсивная линия во вращательном спектре молекулы связана с максимальной относительной заселенностью вращательного уровня энергии. Подстановка найденного в предыдущем примере значения вращательной постоянной для 1 H 35 Cl (
Волновое число вращательного перехода с этого уровня рассчитываем по уравнению (4.43): Длину волны перехода находим из преобразованного относительно уравнения (4.11): 4.2.4 Многовариантное задание № 11 «Вращательные спектры двухатомных молекул» 1. Напишите квантово-механическое уравнение для расчета энергии вращательного движения двухатомной молекулы как жесткого ротатора. 2. Выведите уравнение для расчета изменения энергии вращения двухатомной молекулы как жесткого ротатора при переходе ее на соседний, более высокий квантовый уровень 3. Выведите уравнение зависимости волнового числа вращательных линий в спектре поглощения двухатомной молекулы от вращательного квантового числа. 4. Выведите уравнение для расчета разности волновых чисел соседних линий во вращательном спектре поглощения двухатомной молекулы. 5. Рассчитайте вращательную постоянную (в см -1 и м -1) двухатомной молекулы A по волновым числам двух соседних линий в длинноволновой инфракрасной области вращательного спектра поглощения молекулы (см. таблицу 4.3) . 6. Определите энергию вращения молекулы A на первых пяти квантовых вращательных уровнях (Дж). 7. Вычертите схематически энергетические уровни вращательного движения двухатомной молекулы как жесткого ротатора. 8. Нанесите пунктиром на эту схему вращательные квантовые уровни молекулы, не являющейся жестким ротатором. 9. Выведите уравнение для вычисления равновесного межъядерного расстояния на основании разности волновых чисел соседних линий во вращательном спектре поглощения. 10. Определите момент инерции (кг. м 2) двухатомной молекулы A . 11. Рассчитайте приведенную массу (кг) молекулыA . 12. Вычислите равновесное межъядерное расстояние () молекулы A . Сопоставьте полученное значение со справочными данными. 13. Отнесите наблюдаемые линии во вращательном спектре молекулы A к вращательным переходам. 14. Рассчитайте волновое число спектральной линии, отвечающей вращательному переходу с уровня j для молекулы A (см. таблицу 4.3). 15. Вычислите приведенную массу (кг) изотопозамещенной молекулы B . 16. Рассчитайте волновое число спектральной линии, связанной с вращательным переходомс уровня j для молекулы B (см. таблицу 4.3). Межъядерные расстояния в молекулах A и B считать равными. 17. Определите величину и направление изотопного сдвига во вращательных спектрах молекул A и B для спектральной линии, отвечающей переходус вращательного уровня j . 18. Объясните причину немонотонного изменения интенсивности линийпоглощенияпо мере увеличения энергии вращения молекулы 19. Определите квантовое число вращательного уровня, отвечающего наибольшей относительной заселенности. Рассчитайте длины волн наиболее интенсивных спектральных линий вращательных спектров молекул A и B . Молекулярные спектры
оптические спектры испускания и поглощения, а также комбинационного рассеяния света (См. Комбинационное рассеяние света),
принадлежащие свободным или слабо связанным между собой Молекула м. М. с. имеют сложную структуру. Типичные М. с. - полосатые, они наблюдаются в испускании и поглощении и в комбинационном рассеянии в виде совокупности более или менее узких полос в ультрафиолетовой, видимой и близкой инфракрасной областях, распадающихся при достаточной разрешающей силе применяемых спектральных приборов на совокупность тесно расположенных линий. Конкретная структура М. с. различна для различных молекул и, вообще говоря, усложняется с увеличением числа атомов в молекуле. Для весьма сложных молекул видимые и ультрафиолетовые спектры состоят из немногих широких сплошных полос; спектры таких молекул сходны между собой. h
ν = E
‘ - E
‘’, (1) где h
ν - энергия испускаемого поглощаемого Фотон а частоты ν (h
- Планка постоянная). При комбинационном рассеянии h
ν равно разности энергий падающего и рассеянного фотонов. М. с. гораздо сложнее линейчатых атомных спектров, что определяется большей сложностью внутренних движений в молекуле, чем в атомах. Наряду с движением электронов относительно двух или более ядер в молекулах происходят колебательное движение ядер (вместе с окружающими их внутренними электронами) около положений равновесия и вращательное движение молекулы как целого.
Этим трём видам движений - электронному, колебательному и вращательному - соответствуют три типа уровней энергии и три типа спектров. Согласно квантовой механике, энергия всех видов движения в молекуле может принимать лишь определённые значения, т. е. она квантуется. Полная энергия молекулы E
приближённо может быть представлена в виде суммы квантованных значений энергий трёх видов её движения: E
= E
эл + E
кол + E
вращ. (2) По порядку величин где m
- масса электрона, а величина М
имеет порядок массы ядер атомов в молекуле, т. е. m/М
Молекулярные спектры 10 -3 -10 -5 , следовательно: E
эл >> E
кол >> E
вращ. (4) Обычно E
эл порядка нескольких эв
(несколько сотен кдж/моль
),
E
кол Молекулярные спектры 10 -2 -10 -1 эв, E
вращ Молекулярные спектры 10 -5 -10 -3 эв.
В соответствии с (4) система уровней энергии молекулы характеризуется совокупностью далеко отстоящих друг от друга электронных уровней (различные значения E
эл при E
кол = E
вращ = 0), значительно ближе друг к другу расположенных колебательных уровней (различные значения E
кол при заданном E
л и E
вращ = 0) и ещё более близко расположенных вращательных уровней (различные значения E
вращ при заданных E
эл и E
кол). На рис. 1
приведена схема уровней двухатомной молекулы; для многоатомных молекул система уровней ещё более усложняется. Электронные уровни энергии (E
эл в (2) и на схеме рис. 1
соответствуют равновесным конфигурациям молекулы (в случае двухатомной молекулы характеризуемым равновесным значением r
0 межъядерного расстояния r
, см. рис. 1
в ст. Молекула). Каждому электронному состоянию соответствуют определённая равновесная конфигурация и определённое значение E
эл; наименьшее значение соответствует основному уровню энергии. Набор электронных состояний молекулы определяется свойствами её электронной оболочки. В принципе значения E
эл можно рассчитать методами квантовой химии (См. Квантовая химия),
однако данная задача может быть решена только с помощью приближённых методов и для сравнительно простых молекул. Важнейшую информацию об электронных уровнях молекулы (расположение электронных уровней энергии и их характеристики), определяемую её химическим строением, получают, изучая её М. с. Весьма важная характеристика заданного электронного уровня энергии - значение квантового числа (См. Квантовые числа) S,
характеризующего абсолютную величину полного спинового момента всех электронов молекулы. Химически устойчивые молекулы имеют, как правило, чётное число электронов, и для них S
= 0, 1, 2... (для основного электронного уровня типично значение S
= 0, а для возбуждённых - S
= 0 и S
= 1). Уровни с S
= 0 называются синглетными, с S
= 1 - триплетными (т. к. взаимодействие в молекуле приводит к их расщеплению на χ = 2S
+ 1 = 3 подуровня; см. Мультиплетность).
Радикалы свободные имеют, как правило, нечётное число электронов, для них S
= 1 / 2 , 3 / 2 , ... и типично как для основного, так и для возбуждённых уровней значение S
= 1 / 2 (дублетные уровни, расщепляющиеся на χ = 2 подуровня). Для молекул, равновесная конфигурация которых обладает симметрией, электронные уровни можно дополнительно классифицировать. В случае двухатомных и линейных трёхатомных молекул, имеющих ось симметрии (бесконечного порядка), проходящую через ядра всех атомов (см. рис. 2
, б),
электронные уровни характеризуются значениями квантового числа λ, определяющего абсолютную величину проекции полного орбитального момента всех электронов на ось молекулы. Уровни с λ = 0, 1, 2, ... обозначаются соответственно Σ, П, Δ..., а величина χ указывается индексом слева вверху (например, 3 Σ, 2 π, ...). Для молекул, обладающих центром симметрии, например CO 2 и C 6 H 6 (см. рис. 2
, б, в), все электронные уровни делятся на чётные и нечётные, обозначаемые индексами g
и u
(в зависимости от того, сохраняет ли волновая функция знак при обращении в центре симметрии или меняет его). Колебательные уровни энергии (значения Е
кол) можно найти квантованием колебательного движения, которое приближённо считают гармоническим. В простейшем случае двухатомной молекулы (одна колебательная степень свободы, соответствующая изменению межъядерного расстояния r
) её рассматривают как гармонический Осциллятор ;
его квантование даёт равноотстоящие уровни энергии: E
кол = h
ν e (υ +1/2), (5) где ν e - основная частота гармонических колебаний молекулы, υ - колебательное квантовое число, принимающее значения 0, 1, 2, ... На рис. 1
показаны колебательные уровни для двух электронных состояний. Для каждого электронного состояния многоатомной молекулы, состоящей из N
атомов (N
≥ 3) и имеющей f
колебательных степеней свободы (f
= 3N
- 5 и f
= 3N
- 6 для линейных и нелинейных молекул соответственно), получается f
т. н. нормальных колебаний с частотами ν i (i
= 1, 2, 3, ..., f
) и сложная система колебательных уровней: где υ
i = 0, 1, 2, ... - соответствующие колебательные квантовые числа. Набор частот нормальных колебаний в основном электронном состоянии является очень важной характеристикой молекулы, зависящей от её химического строения. В определённом нормальном колебании участвуют все атомы молекулы или часть их; атомы при этом совершают гармонические колебания с одной частотой v
i , но с различными амплитудами, определяющими форму колебания. Нормальные колебания разделяют по их форме на валентные (при которых изменяются длины линий связи) и деформационные (при которых изменяются углы между химическими связями - валентные углы). Число различных частот колебаний для молекул низкой симметрии (не имеющих осей симметрии порядка выше 2) равно 2, и все колебания являются невырожденными, а для более симметричных молекул имеются дважды и трижды вырожденные колебания (пары и тройки совпадающих по частоте колебаний). Например, у нелинейной трёхатомной молекулы H 2 O (рис. 2
, а) f
= 3 и возможны три невырожденных колебания (два валентных и одно деформационное). Более симметричная линейная трёхатомная молекула CO 2 (рис. 2
, б) имеет f
= 4 - два невырожденных колебания (валентных) и одно дважды вырожденное (деформационное). Для плоской высокосимметричной молекулы C 6 H 6 (рис. 2
, в) получается f
= 30 - десять невырожденных и 10 дважды вырожденных колебаний; из них 14 колебаний происходят в плоскости молекулы (8 валентных и 6 деформационных) и 6 неплоских деформационных колебаний - перпендикулярно этой плоскости. Ещё более симметричная тетраэдрическая молекула CH 4 (рис. 2
, г) имеет f
=
9 - одно невырожденное колебание (валентное), одно дважды вырожденное (деформационное) и два трижды вырожденных (одно валентное и одно деформационное). Вращательные уровни энергии можно найти квантованием вращательного движения молекулы, рассматривая её как твёрдое тело с определёнными моментами инерции (См. Момент инерции). В простейшем случае двухатомной или линейной многоатомной молекулы её энергия вращения где I
- момент инерции молекулы относительно оси, перпендикулярной оси молекулы, а М
- вращательный момент количества движения. Согласно правилам квантования, где вращательное квантовое число J
= 0, 1, 2, ..., и, следовательно, для E
вращ получили: где вращательная постоянная рис. 1
показаны вращательные уровни для каждого электронно-колебательного состояния. Различные типы М. с. возникают при различных типах переходов между уровнями энергии молекул. Согласно (1) и (2) ΔE
= E
‘ - E
‘’ = ΔE
эл + ΔE
кол + ΔE
вращ, (8) где изменения ΔE
эл, ΔE
кол и ΔE
вращ электронной, колебательной и вращательной энергий удовлетворяют условию: ΔE
эл >> ΔE
кол >> ΔE
вращ (9) [расстояния между уровнями того же порядка, что и сами энергии E
эл, E
ол и E
вращ, удовлетворяющие условию (4)]. При ΔE
эл ≠ 0 получаются электронные М. с., наблюдаемые в видимой и в ультрафиолетовой (УФ) областях. Обычно при ΔE
эл ≠ 0 одновременно ΔE
кол ≠ 0 и ΔE
вращ ≠ 0; различным ΔE
кол при заданном ΔE
эл соответствуют различные колебательные полосы (рис. 3
), а различным ΔE
вращ при заданных ΔE
эл и ΔE
кол - отдельные вращательные линии, на которые распадается данная полоса; получается характерная полосатая структура (рис. 4
). Совокупность полос с заданным ΔE
эл (соответствующим чисто электронному переходу с частотой v
эл = ΔE
эл /h
) называемая системой полос; отдельные полосы обладают различной интенсивностью в зависимости от относительных вероятностей переходов (см. Квантовые переходы), которые могут быть приближённо рассчитаны квантовомеханическими методами. Для сложных молекул полосы одной системы, соответствующие данному электронному переходу, обычно сливаются в одну широкую сплошную полосу, могут накладываться друг на друга и несколько таких широких полос. Характерные дискретные электронные спектры наблюдаются в замороженных растворах органических соединений (см. Шпольского эффект). Электронные (точнее, электронно-колебательно-вращательные) спектры изучаются экспериментально при помощи спектрографов и спектрометров со стеклянной (для видимой области) и кварцевой (для УФ-области) оптикой, в которых для разложения света в спектр применяются призмы или дифракционные решётки (см. Спектральные приборы).
При ΔE
эл = 0, а ΔE
кол ≠ 0 получаются колебательные М. с., наблюдаемые в близкой (до нескольких мкм
) и в средней (до нескольких десятков мкм
) инфракрасной (ИК) области, обычно в поглощении, а также в комбинационном рассеянии света. Как правило, одновременно ΔE
вращ ≠ 0 и при заданном E
кол получается колебательная полоса, распадающаяся на отдельные вращательные линии. Наиболее интенсивны в колебательных М. с. полосы, соответствующие Δυ
= υ
’ - υ
’’ = 1 (для многоатомных молекул - Δυ
i = υ
i ’ - υ
i ’’= 1 при Δυ
k = υ
k ’ - υ
k ’’ = 0, где k
≠ i). Для чисто гармонических колебаний эти Отбора правила ,
запрещающие др. переходы, выполняются строго; для ангармонических колебаний появляются полосы, для которых Δυ
> 1 (обертоны); их интенсивность обычно мала и убывает с увеличением Δυ
. Колебательные (точнее, колебательно-вращательные) спектры изучаются экспериментально в ИК-области в поглощении при помощи ИК-спектрометров с призмами, прозрачными для ИК-излучения, или с дифракционными решётками, а также Фурье-спектрометров и в комбинационном рассеянии при помощи светосильных спектрографов (для видимой области) с применением лазерного возбуждения. При ΔE
эл = 0 и ΔE
кол = 0 получаются чисто вращательные М. с., состоящие из отдельных линий. Они наблюдаются в поглощении в далёкой (сотни мкм
)
ИК-области и особенно в микроволновой области, а также в спектрах комбинационного рассеяния. Для двухатомных и линейных многоатомных молекул (а также для достаточно симметричных нелинейных многоатомных молекул) эти линии равно отстоят (в шкале частот) друг от друга с интервалами Δν = 2B
в спектрах поглощения и Δν = 4B
в спектрах комбинационного рассеяния. Чисто вращательные спектры изучают в поглощении в далёкой ИК-области при помощи ИК-спектрометров со специальными дифракционными решётками (эшелеттами) и Фурье-спектрометров, в микроволновой области при помощи микроволновых (СВЧ) спектрометров (см. Микроволновая спектроскопия),
а также в комбинационном рассеянии при помощи светосильных спектрографов. Методы молекулярной спектроскопии, основанные на изучении М. с., позволяют решать разнообразные задачи химии, биологии и др. наук (например, определять состав нефтепродуктов, полимерных веществ и т. п.). В химии по М. с. изучают структуру молекул. Электронные М. с. дают возможность получать информацию об электронных оболочках молекул, определять возбуждённые уровни и их характеристики, находить энергии диссоциации молекул (по схождению колебательных уровней молекулы к границам диссоциации). Исследование колебательных М. с. позволяет находить характеристические частоты колебаний, соответствующие определённым типам химических связей в молекуле (например, простых двойных и тройных связей С-С, связей С-Н, N-Н, О-Н для органических молекул), различных групп атомов (например, CH 2 , CH 3 , NH 2), определять пространственную структуру молекул, различать цис- и транс-изомеры. Для этого применяют как инфракрасные спектры поглощения (ИКС), так и спектры комбинационного рассеяния (СКР). Особенно широкое распространение получил метод ИКС как один из самых эффективных оптических методов изучения строения молекул. Наиболее полную информацию он даёт в сочетании с методом СКР. Исследование вращательных М. с., а также вращательной структуры электронных и колебательных спектров позволяет по найденным из опыта значениям моментов инерции молекул [которые получаются из значений вращательных постоянных, см. (7)] находить с большой точностью (для более простых молекул, например H 2 O) параметры равновесной конфигурации молекулы - длины связей и валентные углы. Для увеличения числа определяемых параметров исследуют спектры изотопических молекул (в частности, в которых водород заменен дейтерием), имеющих одинаковые параметры равновесных конфигураций, но различные моменты инерции. В качестве примера применения М. с. для определения химического строения молекул рассмотрим молекулу бензола C 6 H 6 . Изучение её М. с. подтверждает правильность модели, согласно которой молекула плоская, а все 6 связей С-С в бензольном кольце равноценные и образуют правильный шестиугольник (рис. 2
, б), имеющий ось симметрии шестого порядка, проходящую через центр симметрии молекулы перпендикулярно её плоскости. Электронный М. с. поглощения C 6 H 6 состоит из нескольких систем полос, соответствующих переходам из основного чётного синглетного уровня на возбуждённые нечётные уровни, из которых первый является триплетным, а более высокие - синглетными (рис. 5
). Наиболее интенсивна система полос в области 1840 Å
(E
5 - E
1 = 7,0 эв
), наиболее слаба система полос в области 3400 Å
(E
2 - E
1 = 3,8 эв
),
соответствующая синглетно-триплетному переходу, запрещенному приближёнными правилами отбора для полного спина. Переходы соответствуют возбуждению т. н. π-электронов, делокализованных по всему бензольному кольцу (см. Молекула);
полученная из электронных молекулярных спектров схема уровней рис. 5
находится в согласии с приближёнными квантовомеханическими расчётами. Колебательные М. с. C 6 H 6 соответствуют наличию в молекуле центра симметрии - частоты колебаний, проявляющиеся (активные) в ИКС, отсутствуют (неактивные) в СКР и наоборот (т. н. альтернативный запрет). Из 20 нормальных колебаний C 6 H 6 4 активны в ИКС и 7 активны в СКР, остальные 11 неактивны как в ИКС, так и в СКР. Значения измеренных частот (в см -1
):
673, 1038, 1486, 3080 (в ИКС) и 607, 850, 992, 1178, 1596, 3047, 3062 (в СКР). Частоты 673 и 850 соответствуют неплоским колебаниям, все остальные частоты - плоским колебаниям. Особо характерны для плоских колебаний частота 992 (соответствующая валентному колебанию связей С-С, состоящему в периодическом сжатии и растяжении бензольного кольца), частоты 3062 и 3080 (соответствующие валентным колебаниям связей С-Н) и частота 607 (соответствующая деформационному колебанию бензольного кольца). Наблюдаемые колебательные спектры C 6 H 6 (и аналогичные им колебательные спектры C 6 D 6) находятся в очень хорошем согласии с теоретическими расчётами, позволившими дать полную интерпретацию этих спектров и найти формы всех нормальных колебаний. Подобным же образом можно при помощи М. с. определять структуру разнообразных классов органических и неорганических молекул, вплоть до весьма сложных, например молекул полимеров. Лит.:
Кондратьев В. Н., Структура атомов и молекул, 2 изд., М., 1959; Ельяшевич М. А., Атомная и молекулярная спектроскопия, М., 1962; Герцберг Г., Спектры и строение двухатомных молекул, пер. с англ., М., 1949; его же, Колебательные и вращательные спектры многоатомных молекул, пер. с англ., М., 1949; его же, Электронные спектры и строение многоатомных молекул, пер. с англ., М., 1969; Применение спектроскопии в химии, под ред. В. Веста, пер. с англ., М., 1959. М. А. Ельяшевич.
Рис. 4. Вращательное расщепление электронно-колебательной полосы 3805 Å молекулы N 2 . Рис. 1. Схема уровней энергии двухатомной молекулы: а и б - электронные уровни; v
" и v
" - квантовые числа колебательных уровней. J
" и J
" - квантовые числа вращательных уровней. Рис. 2. Равновесные конфигурации молекул: а - H 2 O; б - CO 2 ; в - C 6 H 6 ; г - CH 4 . Числами указаны длины связей (в Å) и величины валентных углов. Рис. 5. Схема электронных уровней и переходов для молекулы бензола. Энергия уровней дана в эв
. С - синглетные уровни; Т - триплетный уровень. Чётность уровня указана буквами g и u. Для систем полос поглощения указаны примерные области длин волн в Å, более интенсивные системы полос обозначены более жирными стрелками. Рис. 3. Электронно-колебательный спектр молекулы N 2 в близкой ультрафиолетовой области; группы полос соответствуют различным значениям Δv
= v
" - v
". Большая советская энциклопедия. - М.: Советская энциклопедия
.
1969-1978
.
Смотреть что такое "Молекулярные спектры" в других словарях:Спектры испускания, поглощения и комбинационного рассеяния света (КРС), принадлежащие свободным или слабо связанным между собой молекулам. Типичные М. с. полосатые, они наблюдаются в виде совокупности более или менее узких полос в УФ, видимой и… … Физическая энциклопедия МОЛЕКУЛЯРНЫЕ СПЕКТРЫ, спектры испускания, поглощения и рассеяния излучения, принадлежащие свободным или слабо связанным молекулам. Возникают при квантовых переходах между электронными, колебательными и вращательными уровнями энергии молекул.… … Современная энциклопедия - спектры испускания и поглощения электромагн. излучения и комбинац. рассеяния света, принадлежащие свободным или слабо связанным молекулам. Имеют вид совокупности полос (линий) в рентгеновской, УФ, видимой, ИК и радиоволновой (в т. ч.… … Химическая энциклопедия Спектры оптические поглощения, испускания и комбинационного рассеяния света, возникающие при переходах молекул с одних уровней энергии на другие. М. с. состоят из более или менее широких полос, образов. множеством тесно располож. спектральных… … Большой энциклопедический политехнический словарь Оптич. спектры испускания, поглощения и рассеяния света, принадлежащие свободным или слабо связанным молекулам. Состоят из спектральных полос и линий, структура и расположение к рых типичны для испускающих их молекул. Возникают при квантовых… … Естествознание. Энциклопедический словарь Спектры эл. магн. излучения в ИК, видимом и УФ диапазонах шкалы электромагнитных волн. С. о. разделяют на спектры испускания (наз. также спектрами излучения, или эмиссионными спектрами), спектры поглощения (абсорбционные спектры), рассеяния и… … Физическая энциклопедия Спектры (См. Спектры оптические) электромагнитного излучения в инфракрасном, видимом и ультрафиолетовом диапазонах шкалы электромагнитных волн (См. Электромагнитные волны). С. о. разделяют на спектры испускания (называемые также спектрами … Большая советская энциклопедия Молекулярные спектры, обусловленные вращением молекулы как целого. Так как вращение молекулы квантовано, В. с. состоят из отдельных (почти равноотстоящих) линий, т. е. имеют дискретный характер. В. с. наблюдаются в далёкой инфракрасной… … Большая советская энциклопедия, Очкин Владимир Николаевич. Описаны возможности и современное состояние исследований низкотемпературной плазмы методами классической и лазерной спектроскопии. Рассматриваются вопросы физической интерпретации результатов… МОЛЕКУЛЯРНЫЕ СПЕКТРЫ
Спектры испускания, поглощения и комбинационного рассеяния света (КРС), принадлежащие свободным или слабо связанным между собой молекулам. Типичные М. с.- полосатые, они наблюдаются в виде совокупности более или менее узких полос в УФ, видимой и ИК областях спектра; при достаточной разрешающей способности спектральных приборов мол. полосы распадаются на совокупность тесно расположенных линий. Структура М. с. различна для разл. молекул и усложняется с увеличением числа атомов в молекуле. Видимые и УФ спектры весьма сложных молекул сходны между собой и состоят из немногих широких сплошных полос. М. с. возникают при квантовых переходах между уровнями энергии?" и?" молекул согласно соотношению: где hv - энергия испускаемого или поглощаемого фотона частоты v. При КРС hv равна разности энергий падающего и рассеянного фотонов. М. с. гораздо сложнее атомных спектров, что определяется большей сложностью внутр. движений в молекуле, т. к. кроме движения эл-нов относительно двух и более ядер в молекуле происходит колебат. движение ядер (вместе с окружающими их внутр. эл-нами) около положения равновесия и вращат. движения её как целого. Электронному, колебат. и вращат. движениям молекулы соответствуют три типа уровней энергии?эл, ?кол и?вр н три типа М. с. Согласно квант. механике, энергия всех видов движения в молекуле может принимать только определённые значения (квантуется). Полная энергия молекулы? приближённо может быть представлена в виде суммы квантованных значений энергий, соответствующих трём видам её внутр. движений: ?»?эл +?кол+?вр, (2) причём по порядку величины Эл:?кол:?вр = 1: ?m/M:m/M, (3) где т - масса эл-на, а М имеет порядок массы ядер атомов в молекуле, т. Эл -> ?кол ->?вр. (4) Обычно?эл порядка неск. эВ (сотен кДж/моль), ?кол = 10-2-10-1 эВ, ?вр=10-5-10-3 эВ. Система уровней энергии молекулы характеризуется совокупностями далеко отстоящих друг от друга электронных уровней энергии (разл. ?эл при?кол=?вр=0). расположенных значительно ближе друг к другу колебательных уровней (разл. ?кол при заданном?эл и?вр=0) и ещё более близких друг к другу вращательных уровней (значения?вр при заданных?эл и?кол). Электронные уровни энергии а к б на рис. 1 соответствуют равновесным конфигурациям молекулы. Каждому электронному состоянию соответствует определённая равновесная конфигурация и определённое значение?эл; наименьшее значение соответствует осн. электронному состоянию (осн. электронный уровень энергии молекулы). Рис. 1. Схема Уровней энергии двухатомной молекулы, а и б - электронные уровни; v" и v" - квант. числа колебат. уровней; J" и J" - квант. числа вращат. уровней. Набор электронных состояний молекулы определяется св-вами её электронной оболочки. В принципе значения?эл можно рассчитать методами квант. химии, однако эта задача решается только приближённо и для сравнительно простых молекул. Важную информацию об электронных уровнях молекул (их расположении и их хар-ках), определяемую её хим. строением, получают, изучая М. с. Весьма важная хар-ка электронного уровня энергии - значение квантового числа 5, определяющего абс. величину полного спинового момента всех эл-нов. Химически устойчивые молекулы имеют, как правило, чётное число эл-нов, и для них 5 = 0, 1, 2, . . .; для осн. электронного уровня типично 5=0, для возбуждённых - 5 = 0 и 5=1. Уровни с S=0 наз. синглетными, с S=1 - триплетными (т. к. их мулътиплетность c=2S+1=3). В случае двухатомных и линейных трёхатомных молекул электронные уровни характеризуются значением квант. числа Л, определяющего абс. величину проекции полного орбитального момента всех эл-нов на ось молекулы. Уровни с L=0, 1, 2, ... обозначаются соответственно S, П, D, . . ., а и указывается индексом слева вверху (напр., 3S, 2П). Для молекул, обладающих центром симметрии (напр., СО2, СН6), все электронные уровни делятся на чётные и нечётные (g и u соответственно) в зависимости от того, сохраняет или нет определяющая их волновая функция знак при обращении в центре симметрии. Колебательные уровни энергии можно найти квантованием колебат. движения, к-рое приближённо считают гармоническим. Двухатомную молекулу (одна колебат. степень свободы, соответствующая изменению межъядерного расстояния r) можно рассматривать как гармонич. осциллятор, квантование к-рого даёт равноотстоящие уровни энергии: где v - осн. частота гармонич. колебаний молекулы, v=0, 1, 2, . . .- колебат. квант. число. Для каждого электронного состояния многоатомной молекулы, состоящей из N?3 атомов и имеющей f Колебат. степеней свободы (f=3N-5 и f=3N-6 для линейных и нелинейных молекул соответственно), получается / т. н. нормальных колебаний с частотами vi(ill, 2, 3, . . ., f) и сложная система колебат. уровней энергии: Набор частот норм. колебаний в осн. электронном состоянии явл. важной хар-кой молекулы, зависящей от её хим. строения. В определённом норм. колебании участвуют либо все атомы молекулы, либо их часть; атомы совершают гармонич. колебания с одинаковой частотой vi, но с разл. амплитудами, определяющими форму колебания. Норм. колебания разделяют по форме на валентные (изменяются длины хим. связей) и деформационные (изменяются углы между хим. связями - валентные углы). Для молекул низшей симметрии (см. СИММЕТРИЯ МОЛЕКУЛЫ) f=2 и все колебания невырожденные; для более симметричных молекул имеются дважды и трижды вырожденные колебания, т. е. пары и тройки совпадающих по частоте колебаний. Вращательные уровни энергии можно найти квантованием вращат. движения молекулы, рассматривая её как тв. тело с определёнными моментами инерции. В случае двухатомной или линейной трёхатомной молекулы её энергия вращения?вр=М2/2I, где I - момент инерции молекулы относительно оси, перпендикулярной оси молекулы, а М - вращат. момент кол-ва движения. Согласно правилам квантования, M2=(h/4pi2)J(J+1), где f=0, 1,2,. . .- вращательное квант. число; для?вр получаем: Вр=(h2/8pi2I)J(J+1) = hBJ(J+1), (7) где вращат. постоянная В=(h/8piI2)I определяет масштаб расстояний между уровнями энергии, уменьшающийся с увеличением масс ядер и межъядерных расстояний. Разл. типы М. с. возникают при разл. типах переходов между уровнями энергии молекул. Согласно (1) и (2): D?=?"-?"==D?эл+D?кол+D?вр, причём аналогично (4) D?эл->D?кол->D?вр. При D?эл?0 получаются электронные М. с., наблюдаемые в видимой и УФ областях. Обычно при D??0 одновременно D?кол?0 и D?вр?0; разл. D?кол при заданном D?эл соответствуют разл. колебат. полосы (рис. 2), а разл. D?вр при заданных D?эл и D?кол отд. вращат. линии, на к-рые распадаются колебат. полосы (рис. 3).  Рис. 2. Электроино-колебат. спектр молекулы N2 в близкой УФ области; группы полос соответствуют разл. значениям Dv= v"-v". Совокупность полос с заданным D?эл (соответствующих чисто электронному переходу с частотой nэл=D?эл/h) наз. системой полос; полосы обладают разл. интенсивностью в зависимости от относит. вероятностей переходов (см. КВАНТОВЫЙ ПЕРЕХОД).  Рис. 3. Вращат. расщепление электронно-колсбат. полосы 3805,0 ? молекулы N2. Для сложных молекул полосы одной системы, соответствующие данному электронному переходу, обычно сливаются в одну широкую сплошную полосу; могут накладываться друг на друга и неск. таких полос. Характерные дискретные электронные спектры наблюдаются в замороженных р-рах органич. соединений. Электронные (точнее, электронно-колебательно-вращательные) спектры изучаются с помощью спектральных приборов со стеклянной (видимая область) и кварцевой (УФ область, (см. УЛЬТРАФИОЛЕТОВОЕ ИЗЛУЧЕНИЕ)) оптикой. При D?эл = 0, а D?кол?0 получаются колебат. М. с., наблюдаемые в ближней ИК области обычно в спектрах поглощения и КРС. Как правило, при заданном D?кол D?вр?0 и колебат. полоса распадается на отд. вращат. линии. Наиболее интенсивны в колебат. М. с. полосы, удовлетворяющие условию Dv=v"- v"=1 (для многоатомных молекул Dvi=v"i- v"i=1 при Dvk=V"k-V"k=0; здесь i и k определяют разл. нормальные колебания). Для чисто гармонич. колебаний эти правила отбора выполняются строго; для ангармонич. колебаний появляются полосы, для к-рых Dv>1 (обертоны); их интенсивность обычно мала и убывает с увеличением Dv. Колебат. М. с. (точнее, колебательно-вращательные) изучают с помощью ИК спектрометров и фурье-спектрометров, а спектры КРС - при помощи светосильных спектрографов (для видимой области) с применением лазерного возбуждения. При D?эл=0 и D?кол=0 получаются чисто вращат. спектры, состоящие из отд. линий. Они наблюдаются в спектрах поглощения в далёкой ИК области и особенно в микроволновой области, а также в спектрах КРС. Для двухатомных, линейных трёхатомных молекул и достаточно симметричных нелинейных молекул эти линии равноотстоят (в шкале частот) друг от друга. Чисто вращат. М. с. изучают с помощью ИК спектрометров со спец. дифракц. решётками (эшелеттами), фурье-спектрометров, спектрометров на основе лампы обратной волны, микроволновых (СВЧ) спектрометров (см. СУБМИЛЛИМЕТРОВАЯ СПЕКТРОСКОПИЯ, МИКРОВОЛНОВАЯ СПЕКТРОСКОПИЯ), а вращат. спектры КРС - с помощью светосильных спектрометров. Методы молекулярной спектроскопии, основанной на изучении М. с., позволяют решать разнообразные задачи химии. Электронные М. с. дают информацию об электронных оболочках, возбуждённых уровнях энергии и их хар-ках, об энергии диссоциации молекул (по схождению уровней энергии к границе диссоциации). Исследование колебат. спектров позволяет находить характеристические частоты колебаний, соответствующие наличию в молекуле определённых типов хим. связей (напр., двойных и тройных связей С-С, связей С-Н, N-Н для органич. молекул), определять пространств. структуру, различать цис- и транс-изомеры (см. ИЗОМЕРИЯ МОЛЕКУЛ). Особо широкое распространение получили методы инфракрасной спектроскопии - одни из наиболее эффективных оптич. методов изучения строения молекул. Наиболее полную информацию они дают в сочетании с методами спектроскопии КСР. Исследование вращат. спектров, а также вращат. структуры электронных и колебат. М. с. позволяет по найденным из опыта моментам инерции молекул находить с большой точностью параметры равновесных конфигураций - длины связей и валентные углы. Для увеличения числа определяемых параметров исследуют спектры изотопич. молекул (в частности, молекул, в к-рых водород заменён дейтерием), имеющих одинаковые параметры равновесных конфигураций, но разл. моменты инерции. М. с. применяются также в спектральном анализе для определения состава в-ва.
Исследования молекулярных спектров позволяют определить силы, действующие между атомами в молекуле, энергию диссоциации молекулы, ее геометрию, межъядерные расстояния и т.п. , т.е. дают обширную информацию о строении и свойствах молекулы. Под молекулярным спектром, в широком смысле, понимается распределение вероятности переходов между отдельными двумя энергетическими уровнями молекулы (см.рис.9) в зависимости от энергии перехода. Поскольку в дальнейшем будет идти речь об оптических спектрах, то каждый такой переход должен сопровождаться испусканием или поглощением фотона с энергией E n = hn = E 2 – E 1 , 3.1 где E 2 и E 1 – энергии уровней, между которыми происходит переход. Если излучение, состоящее из фотонов испускаемых молекулами газа, пропустить через спектральный прибор, то получится спектр испускания молекулы, состоящий из отдельных ярких (может быть цветных) линий. Причем каждая линия будет соответствовать соответствующему переходу. В свою очередь, яркость и положение линии в спектре зависят от вероятности перехода и энергии (частоты, длины волны) фотона соответственно. Если, напротив, через этот газ, а затем и через спектральный прибор пропустить излучение, состоящее из фотонов всех длин волн (сплошной спектр), то получится спектр поглощения. При этом этот спектр будет представлять собой набор темных линий на фоне яркого сплошного спектра. Контрастность и положение линии в спектре здесь так же зависят от вероятности перехода и энергии фотона. Исходя из сложной структуры энергетических уровней молекулы (см. рис.9) , все переходы между ними можно разделить на отдельные типы, которые дают различный характер спектра молекул. Спектр, состоящий из линий соответствующих переходам между вращательными уровнями (см. рис.8) без изменения колебательного и электронного состояний молекулы, называют вращательным спектром молекулы. Так как энергия вращательного движения лежит в пределах 10 -3 -10 -5 эВ, то частота линий в этих спектрах должны лежать в микроволновой области радиочастот (далекая инфракрасная область). Спектр, состоящий из линий соответствующих переходам между вращательными уровнями принадлежащим разным колебательным состояниям молекулы в одном и том же электронном состоянии, называют колебательно-вращательным или просто колебательным спектром молекулы. Эти спектры, при энергиях колебательного движения 10 -1 -10 -2 эВ, лежат в инфракрасной области частот. Наконец, спектр, состоящий из линий соответствующих переходам между вращательными уровнями принадлежащим разным электронным и колебательным состояниям молекулы, называют электронно-колебательно-вращательным или просто электронным спектром молекулы. Эти спектры лежат в видимой и ультрафиолетовой областях частот, т.к. энергия электронного движения составляет несколько электронвольт. Поскольку испускание (или поглощение) фотона есть электромагнитный процесс, то его необходимым условием является наличие или, точнее, изменение электрического дипольного момента, связанного с соответствующим квантовым переходом в молекуле. Отсюда следует, что вращательные и колебательные спектры могут наблюдаться только у молекул, обладающих электрическим дипольным моментом, т.е. состоящих из разнородных атомов. МОЛЕКУЛЯРНЫЕ СПЕКТРЫ
,
спектры испускания и поглощения электромагн. излучения и комбинац. рассеяния
света, принадлежащие свободным или слабо связанным молекулам . Имеют вид совокупности
полос (линий) в рентгеновской, УФ, видимой, ИК и радиоволновой (в т.ч. микроволновой)
областях спектра. Положение полос (линий) в спектрах испускания (эмиссионных
молекулярных спектров) и поглощения (абсорбционных молекулярных спектров) характеризуется частотами v
(длинами волн l = c/v, где с-скорость света) и волновыми числами=
1/l; оно определяется разностью энергий Е" и Е:
тех состояний
молекулы , между к-рыми происходит квантовый переход :
(h-постоянная Планка).
При комбинац. рассеянии величина hv равна разности энергий падающих и
рассеянных фотонов. Интенсивность полос (линий) связана с кол-вом (концентрацией)
молекул данного вида, заселенностью уровней энергии Е" и Е:
и
вероятностью соответствующего перехода. Вероятность переходов с
испусканием или поглощением излучения определяется прежде всего квадратом матричного
элемента электрич. дипольного момента перехода, а при более точном рассмотрении
- и квадратами матричных элементов магн. и электрич. квадрупольного моментов
молекулы (см. Квантовые переходы). При комбинац. рассеянии света вероятность
перехода связана с матричным элементом наведенного (индуцированного) дипольного
момента перехода молекулы , т.е. с матричным элементом поляризуемости молекулы . Состояния мол. систем,
переходы между к-рыми проявляются в виде тех или иных молекулярных спектров, имеют разную природу
и сильно различаются по энергии. Уровни энергии нек-рых видов расположены далеко
друг от друга, так что при переходах молекула поглощает или испускает высокочастотное
излучение. Расстояние между уровнями др. природы бывает мало, а в нек-рых случаях
в отсутствие внеш. поля уровни сливаются (вырождаются). При малых разностях
энергий переходы наблюдаются в низкочастотной области. Напр., ядра атомов нек-рых
элементов обладают собств. магн. моментом и электрич. квадрупольным моментом ,
связанным со спином . Электроны также имеют магн. момент, связанный с их спином .
В отсутствие внеш. поля ориентации магн. моментов произвольны, т.е. они не квантуются
и соответствующие энергетич. состояния вырождены. При наложении внеш. постоянного
магн. поля происходит снятие вырождения и возможны переходы между уровнями энергии,
наблюдаемые в радиочастотной области спектра. Так возникают спектры ЯМР и ЭПР
(см. Ядерный магнитный резонанс , Электронный парамагнитный резонанс). Распределение по кинетич.
энергиям электронов , испускаемых мол. системами в результате облучения рентгеновским
или жестким УФ излучением, дает рентгеноэмктронная
спектроскопия
и фотоэлектронная спектроскопия . Дополнит. процессы в мол. системе,
вызванные первоначальным возбуждением, приводят к появлению и др. спектров.
Так, оже-спектры возникают в результате релаксац. захвата электрона с внеш.
оболочки к.-л. атома на вакантную внутр. оболочку, а высвободившаяся энергия
превращ. в кинетич. энергию др. электрона внеш. оболочки, испускаемого атомом .
При этом осуществляется квантовый переход из нек-рого состояния нейтральной
молекулы в состояние мол. иона (см. Оже-спектроскопия). Традиционно к собственно
молекулярным спектрам относят лишь спектры, связанные с оптич. переходами между электронно-колеба-тельно-вращат,
уровнями энергии молекулы , связанными с тремя осн. типами энергетич. уровней
молекулы - электронными Е эл, колебательными Е кол
и вращательными Е вр, соответствующими трем типам внутр.
движения в молекуле . За Е эл принимают энергию равновесной
конфигурации молекулы в данном электронном состоянии. Набор возможных электронных
состояний молекулы определяется св-вами ее электронной оболочки и симметрией .
Колебат. движения ядер в молекуле относительно их равновесного положения в каждом
электронном состоянии квантуются так, что при нескольких колебат. степенях свободы
образуется сложная система колебат. уровней энергии Е кол.
Вращение молекулы в целом как жесткой системы связанных ядер характеризуется
вращат. моментом кол-ва движения, к-рый квантуется, образуя вращат. состояния
(вращат. уровни энергии) Е вр. Обычно энергия электронных переходов
порядка неск. эВ, колебательных-10 -2 ... 10 -1 эВ, вращательных-10 -5
... 10 -3 эВ. В зависимости от того, между какими уровнями энергии происходят переходы с испусканием, поглощением или комбинац. рассеянием электромагн. излучения - электронными, колебат. или вращательными, различают электронные, колебат. и вращательные молекулярные спектры. В статьях Электронные спектры , Колебательные спектры , Вращательные спектры приведены сведения о соответствующих состояниях молекул , правилах отбора для квантовых переходов , методах мол. спектроскопии , а также о том, какие характеристики молекул м. б. получены из молекулярных спектров: св-ва и симметрия электронных состояний, колебат. постоянные, энергия диссоциации , симметрия молекулы , вращат. постоянные, моменты инерции, геом. параметры, электрич. дипольные моменты , данные о строении и внутр. силовых полях и т. п. Электронные спектры поглощения и люминесценции в видимой и УФ областях дают информацию о распределении |
| Читайте: |
|---|
Популярное:
Новое
- Студенческие строительные отряды (ссо - вссо) Движение вссо как называли в ссср
- Целебные свойства марганцовки — полезные советы
- Подготовка к егэ по обществознанию
- Гитлер в «Mein Kampf»: «Русские – великий народ» - aquilaaquilonis
- Бои на Халхин-Голе (1939)
- Умножение на однозначное число столбиком
- Методическая разработка семинара для педагогов дополнительного образования на тему «Создание развивающей образовательной среды для обучающихся на занятиях
- Ноев ковчег. Ковчег спасения. Значение «ноев ковчег Что означает фразеологизм ноев ковчег
- Презентация по физике на тему "звуковые волны"
- Как решать уравнения с модулем

 .
.
 - энергии электрона на более высоком и более низком уровнях; -
- энергии электрона на более высоком и более низком уровнях; -  - спектральные термы, выраженные в единицах измерения волновых чисел (м -1 , см -1).
- спектральные термы, выраженные в единицах измерения волновых чисел (м -1 , см -1).
 =25,9 кДж/моль,
=25,9 кДж/моль,
 =3,8 кДж/моль.
=3,8 кДж/моль.

 - энергии электронных уровней;
- энергии электронных уровней;
 .
.
 .
.

 .
.
 20
20  12
12 
 ,
,
 . Поправку следует учитывать лишь при очень больших j
.
. Поправку следует учитывать лишь при очень больших j
. . При наличии в молекуле элементов симметрии
. При наличии в молекуле элементов симметрии  - положение линии, отвечающей вращательному переходу
- положение линии, отвечающей вращательному переходу  в изотопозамещенной молекуле.
в изотопозамещенной молекуле. , то отношение волновых чисел соответствует обратному отношению приведенных масс:
, то отношение волновых чисел соответствует обратному отношению приведенных масс: ,
,
 - статистический вес j
-того вращательного уровня энергии, отвечает числу проекций количества движения вращающейся молекулы на ее ось – линию связи молекулы,
- статистический вес j
-того вращательного уровня энергии, отвечает числу проекций количества движения вращающейся молекулы на ее ось – линию связи молекулы,  , энергия нулевого вращательного уровня
, энергия нулевого вращательного уровня  . Функция проходит через максимум при увеличении j
, как иллюстрирует рисунок 4.7 на примере молекулы CO.
. Функция проходит через максимум при увеличении j
, как иллюстрирует рисунок 4.7 на примере молекулы CO. .
.


 см -1
. Рассчитайте вращательную постоянную, момент инерции и равновесное межъядерное расстояние в молекуле.
см -1
. Рассчитайте вращательную постоянную, момент инерции и равновесное межъядерное расстояние в молекуле. см -1
.
см -1
. кг
. м 2
.
кг
. м 2
. и йода
и йода  выражены в кг:
выражены в кг: см -1
см -1 и хлора
и хлора  (выражены в кг):
(выражены в кг):
 энергетический уровень, во вращательном спектре молекулы 1 H 35 Cl при замещении атома хлора на изотоп 37 Cl. Межъядерное расстояние в молекулах 1 H 35 Clи 1 H 37 Clсчитать одинаковым.
энергетический уровень, во вращательном спектре молекулы 1 H 35 Cl при замещении атома хлора на изотоп 37 Cl. Межъядерное расстояние в молекулах 1 H 35 Clи 1 H 37 Clсчитать одинаковым. в спектре молекулы 1 H 37 Clи величину изотопного сдвига по уравнениям (4.35), (4.39), (4.43) и (4.50), соответственно.
в спектре молекулы 1 H 37 Clи величину изотопного сдвига по уравнениям (4.35), (4.39), (4.43) и (4.50), соответственно.
 см -1) в уравнение (4.54) позволяет вычислить номер этого уровня энергии:
см -1) в уравнение (4.54) позволяет вычислить номер этого уровня энергии: .
. .
.