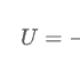Секции на сайта
Избор на редакторите:
- Раздолно (гара) Исторически хроники за селището на раздолно прим край
- Раздолно (гара) Карта на село Раздолное, Приморски край
- Къде да се срещнем с кралицата и епископа
- Резервни части за джип нови и поръчани от САЩ скулптури на Вершински Александър Николаевич
- "chita" все още може да се търси
- Кой град преди е бил столица?
- Полоцко княжество - Руска историческа библиотека Образование и разграничение на княжеството
- Полоцко княжество - Руска историческа библиотека Образование и разграничение на княжеството
- История Кузнецки Острог история
- Понтий Пилат - пети прокуратор на Юдея
Реклама
| Химична формула на сярна киселина. Сярна киселина: химични свойства, характеристики, производство на сярна киселина в производството. Основни руски заводи за производство на сярна киселина |
|
Цели на урока: учениците трябва да познават структурата, физичните и химичните свойства на H 2 SO 4; да могат, въз основа на познанията за скоростта на химичните реакции и химичното равновесие, да обосноват избора на условията за протичане на реакциите, които са в основата на производството на сярна киселина; определят на практика сулфатни и сулфидни йони. Основни понятия: серен анхидрид, серен анхидрид, комплексно използване на суровини. По време на часовете I. Организационен момент; проверка на домашната работа II. Нов материал 1. Електронни и структурни формули. Тъй като сярата е в третия период на периодичната система, правилото на октета не се спазва и серният атом може да придобие до дванадесет електрона. (Шестте електрона на сярата са обозначени със звездичка.) 2. Получаване. Сярна киселина се образува чрез взаимодействие на серен (VI) оксид с вода (SO 3 + H 2 O H 2 SO 4). Описание на производството на сярна киселина е дадено в § 16 (стр. 37 - 42). 3. Физически свойства. Сярната киселина е безцветна, тежка (= 1,84 g / cm 3), нелетлива течност. Когато се разтвори във вода, настъпва много силно загряване. Не забравяйте да не наливате вода в концентрирана сярна киселина (фиг. 2)! Концентрираната сярна киселина абсорбира водната пара от въздуха. Това може да се види, ако отворен съд с концентрирана сярна киселина се балансира балансирано: след известно време чашата с съда ще се спусне.   Ориз. 2. 4. Химични свойства. Разредената сярна киселина има общи свойства, характерни за киселините и специфични (Таблица 7). Таблица 7
Приложение. Сярната киселина е широко използвана (фиг. 3), тя е основният продукт на химическата промишленост.   Ориз. 3. Използването на сярна киселина: 1 - получаване на багрила; 2 - минерални торове; 3 - рафиниране на петролни продукти; 4 - електролитно производство на мед; 5 - електролит в батерии; 6 - получаване на взривни вещества; 7 - багрила; 8 - изкуствена коприна; 9 - глюкоза; 10 - соли; 11 - киселини. Сярната киселина образува две серии соли - средна и кисела: Na 2 SO 4 NaHSO 4 натриев сулфат натриев хидрогенсулфат (средна сол) (кисела сол) Солите на сярна киселина са широко използвани, например Na 2 SO 4 10H 2 O - кристален хидрат на натриев сулфат (солта на Глаубер) се използва при производството на сода, стъкло, в медицината и ветеринарната медицина. CaSO 4 2H 2 O - кристален хидрат на калциев сулфат (естествен гипс) - се използва за получаване на полуводен гипс, който е необходим в строителството, а в медицината - за нанасяне на гипсови отливки. CuSO 4 5H 2 O - кристален хидрат на меден (II) сулфат (меден сулфат) - се използва в борбата с вредителите по растенията. III. Осигуряване на нов материал 1. През зимата между рамките на прозорците понякога се поставя съд с концентрирана сярна киселина. С каква цел се прави това, защо съдът не може да се напълни до върха с киселина? 2. Концентрираната сярна киселина, когато се нагрява, реагира с живак и сребро, по същия начин, по който реагира с мед. Напишете уравненията за тези реакции и посочете окислителя и редуктора. 3. Как да разпознаем сулфидите? Къде се използват? 4. Направете уравненията на реакцията, които са практически осъществими, като използвате следните схеми: Hg + H 2 SO 4 (конц.) MgCl 2 + H 2 SO 4 (конц.) Na 2 SO 3 + H 2 SO 4 Al (OH) 3 + H2SO4 Когато съставяте уравненията на реакциите, посочете условията за тяхното изпълнение. Когато е приложимо, напишете уравненията в йонна и съкратена йонна форма. 5. Назовете окислителя в реакциите: а) разредена сярна киселина с метали; б) концентрирана сярна киселина с метали. 6. Какво знаете за сярната киселина? 7. Защо концентрираната сярна киселина е силно окислител? Какви са специалните свойства на концентрираната сярна киселина? 8. Как взаимодейства концентрираната сярна киселина с металите? 9. Къде се използва сярна киселина и нейните соли? 1. Какъв обем кислород е необходим за горенето: а) 3,4 кг сероводород; б) 6500 m 3 сероводород? 2. Каква е масата на разтвор, съдържащ 0,2 масови фракции сярна киселина, който се изразходва за реакцията с 4,5 g алуминий? Лабораторни експерименти Ви. Разпознаване на сулфатни йони в разтвор. Изсипете 1-2 мл разтвор на натриев сулфат в едната епруветка, същото количество цинков сулфат в другата и разреден разтвор на сярна киселина в третата. Поставете цинкова пелета във всяка епруветка и след това добавете няколко капки бариев хлорид или разтвор на бариев нитрат. Задачи. 1. Как можете да различите сярната киселина от нейните соли? 2. Как да различим сулфатите от другите соли? Напишете уравненията за реакциите, които сте извършили в молекулна, йонна и съкратена йонна форма. IV. Домашна работа Нова тема: Сярна киселина -З 2 ТАКА 4 1. Електронни и структурни формули на сярна киселина * S - сярата е в възбудено състояние 1S 2 2S 2 2P 6 3S 1 3P 3 3d 2 Електронната формула на молекулата на сярна киселина: Структурна формула на молекулата на сярна киселина: 1Н --2О -2О 1Н --2О -2О 2. Получаване: Химичните процеси за производство на сярна киселина могат да бъдат представени като следната диаграма: S + O 2 + O 2 + H 2 O FeS 2 SO 2 SO 3 H 2 SO 4 Сярна киселина се получава на три етапа: 1 -ви етап.Като суровини се използват сяра, железен пирит или сероводород. 4 FeS 2 + 11 O 2 = 2Fe 2 O 3 + 8SO 2 2 сцена. Окисляване на SO 2 до SO 3 с кислород с помощта на V 2 O 5 катализатор 2SO 2 + O 2 = 2SO 3 + Q 3 етап. За превръщането на SO 3 в сярна киселина не се използва вода. има силно нагряване и концентриран разтвор на сярна киселина. SO 3 + H 2 O H 2 SO 4 Резултатът е разтвор на олеумТАКА 3 в сярна киселина. Електрическа схема на устройството(вижте урок страница 105) 3. Физически свойства. а) течност б) безцветен в) тежък (витриолово масло) г) нелетлив г) когато се разтвори във вода, настъпва силно нагряване ( следователно със сигурност трябва да се излее сярна киселинавода, ане обратното!) 4. Химични свойства на сярна киселина.
5. Приложение: Сярна киселина е един от най -важните продукти, използвани в различни индустрии. Основните му потребители са производството на минерални торове, металургията и рафинирането на петролни продукти. Сярната киселина се използва в производството на други киселини, детергенти, експлозиви, лекарства, бои, като електролити за оловно-кисели батерии. (Урок страница 103). 6. Соли на сярна киселина Сярната киселина дисоциира на етапи H 2 SO 4 H + + HSO 4 - HSO 4 - H + + SO 4 2- следователно, той образува два вида сол - сулфати и хидросулфати Например: Na 2 SO 4 - натриев сулфат (средна сол) Na HSO 4 - натриев хидроген сулфат (кисела сол) Най -широко използваните са: Na 2 SO 4 * 10H 2 O - Глауберова сол (използва се при производството на сода, стъкло, в медицината и ветеринарна медицина. СaSO 4 * 2H2O - гипс СuSO 4 * 5H 2 O - меден сулфат (използва се в селското стопанство). Лабораторен опит Химични свойства на сярна киселина. Оборудване: Епруветки. Реактиви:сярна киселина, метил оранжев, цинк, магнезиев оксид, натриев хидроксид и фенолфталеин, натриев карбонат, бариев хлорид. б) Попълнете таблицата за наблюдение Сярна киселина (H2SO4) е една от най -корозивните киселини и опасни реактиви, познати на човека, особено в концентрирана форма. Химически чистата сярна киселина е тежка токсична течност с мазна консистенция, без мирис и цвят. Получава се по метода на окисляване на серен диоксид (SO2) чрез контактния метод. При температура от + 10,5 ° C сярната киселина се превръща в втвърдена стъклена кристална маса, алчно, като гъба, абсорбираща влагата от околната среда. В промишлеността и химията сярната киселина е едно от основните химични съединения и заема водеща позиция по отношение на производството в тонове. Ето защо сярната киселина се нарича „кръвта на химията“. С помощта на сярна киселина се получават торове, лекарства, други киселини, едри, торове и много други. Основни физични и химични свойства на сярна киселина
Концентрирани и разредени серни киселиниКонцентрираните разтвори на сярна киселина включват разтвори от 40% или повече, способни да разтварят сребро или паладий.
Разредената сярна киселина включва разтвори, чиято концентрация е по -малка от 40%. Това не са толкова активни разтвори, но те са способни да реагират с месинг и мед. Производство на сярна киселинаПроизводството на сярна киселина в промишлен мащаб започва през 15 век, но по това време тя се нарича „витриолово масло“. Ако по -рано човечеството е консумирало само няколко десетки литра сярна киселина, то в съвременния свят изчислението стига до милиони тонове годишно.
Сярна киселина се произвежда индустриално и има три от тях:
Нека поговорим подробно за всеки от тях. Метод за производство на контактКонтактният метод на производство е най -често срещаният и изпълнява следните задачи:
При контактния метод следните вещества се използват като суровини:
Преди започване на производствения процес суровините се подготвят предварително. За начало пирит се натрошава в специални дробилни инсталации, което прави възможно, поради увеличаване на контактната площ на активните вещества, да ускори реакцията. Пиритът се пречиства: той се потапя в големи контейнери с вода, по време на които отпадъчните скали и всякакви примеси изплуват на повърхността. В края на процеса те се отстраняват. Производствената част е разделена на няколко етапа:
В процеса на производство, както казахме по -горе, се генерира много топлинна енергия, която се използва за отопление. Много заводи за сярна киселина инсталират парни турбини, които използват отработената пара за генериране на допълнително електричество. Азотен метод за производство на сярна киселинаВъпреки предимствата на контактния метод на производство, при който се получават по -концентрирана и чиста сярна киселина и олеум, много H2SO4 се получава чрез азотен метод. По -специално, в суперфосфатни заводи. За производството на H2SO4, серен диоксид действа като изходен материал, както в контактния, така и в азотния метод. Получава се специално за тези цели чрез изгаряне на сяра или чрез изгаряне на серни метали. Преработката на серен диоксид в сярна киселина се състои в окисляване на серен диоксид и добавяне на вода. Формулата изглежда така: Но серен диоксид не реагира директно с кислород, поради което при азотния метод окисляването на серен диоксид се извършва с азотни оксиди. По -високите азотни оксиди (говорим за азотен диоксид NO2, азотен триоксид NO3) в този процес се редуцират до азотен оксид NO, който впоследствие отново се окислява от кислород до по -високи оксиди. Производството на сярна киселина по азотен метод е технически формализирано по два начина:
Азотният метод има редица предимства и недостатъци. Недостатъци на азотния метод:
Предимства на азотния метод:
Основни руски заводи за производство на сярна киселинаГодишното производство на H2SO4 у нас се изчислява на шест цифри - това е около 10 милиона тона. Водещите производители на сярна киселина в Русия са компании, които освен това са нейните основни потребители. Става дума за компании, чиято сфера на дейност е производството на минерални торове. Например „Балаковски минерални торове“, „Амофос“.
Най -големият производител на титанов диоксид в Източна Европа, Кримски титан, работи в Армянск в Крим. В допълнение, заводът се занимава с производство на сярна киселина, минерални торове, железен сулфат и др. Различни видове сярна киселина се произвеждат в много заводи. Например акумулаторна сярна киселина се произвежда от: Карабашмед, FKP Biysk Oleum Plant, Святогор, Славия, Северхимпром и др. Олеумът се произвежда от UCC Щекиноазот, FKP Biysk Oleum Plant, Ural Mining and Metallurgical Company, PO Kirishinefteorgsintez и др. Сярна киселина с висока чистота се произвежда от OHK Щекиноазот, компонент-реагент. Отработената сярна киселина може да бъде закупена във фабриките ZSS, HaloPolymer Кирово-Чепецк. Производители на техническа сярна киселина са Промсинтез, Кипром, Святогор, Апатит, Карабашмед, Славия, Лукойл-Пермнефтеоргсинтез, Челябинският цинков завод, Електроцинк и др. Поради факта, че пиритът е основната суровина в производството на H2SO4, а това е отпадък от предприятията за обогатяване, негови доставчици са заводите за обогатяване в Норилск и Талнах. Световните лидери в производството на H2SO4 са заети от САЩ и Китай, които представляват съответно 30 милиона тона и 60 милиона тона. Обхват на приложение на сярна киселинаВ света годишно се консумират около 200 милиона тона H2SO4, от които се произвеждат широка гама продукти. Сярна киселина с право държи дланта сред другите киселини по отношение на промишленото използване. Както вече знаете, сярната киселина е един от най -важните продукти на химическата промишленост, така че областта на приложение на сярна киселина е доста широка. Основните насоки за използване на H2SO4 са следните:
Соли на сярна киселина и тяхното използванеНай -важните соли на сярна киселина:
Разредената сярна киселина се използва като електролит в оловно-киселинните батерии. Освен това се използва за производство на детергенти и торове. Но в повечето случаи той идва под формата на олеум - това е разтвор на SO3 във H2SO4 (можете да намерите и други олеум формули). Удивителен факт! Олеумът е по -химически активен от концентрираната сярна киселина, но въпреки това не реагира със стомана! Поради тази причина е по -лесно да го транспортирате, отколкото самата сярна киселина. Полето на използване на „царицата на киселините“ е наистина голямо и е трудно да се каже за всички начини, по които се използва в промишлеността. Използва се и като емулгатор в хранително -вкусовата промишленост, за пречистване на водата, при синтеза на експлозиви и за много други цели. Историята на появата на сярна киселинаКой от нас никога не е чувал за меден сулфат? И така, той е изследван в древността и в някои произведения от началото на новата ера учените обсъждат произхода на витриола и техните свойства. Витриолът е изследван от гръцкия лекар Диоскорид, римския изследовател на природата Плиний Стари и в своите писания те пишат за експериментите, които се провеждат. За медицински цели различни древни куполовидни вещества са използвани от древния лечител Ибн Сина. Как се използва витриол в металургията е споменато в произведенията на алхимиците от древна Гърция Зосима от Панополис. Първият метод за производство на сярна киселина е процесът на нагряване на калиева стипца и за това има информация в алхимичната литература от 13 век. По това време съставът на стипцата и същността на процеса не са били известни на алхимиците, но вече през 15 век те са започнали нарочно да се занимават с химически синтез на сярна киселина. Процесът беше следният: алхимиците обработиха смес от сяра и антимонов (III) сулфид Sb2S3 при нагряване с азотна киселина. В средновековието в Европа сярната киселина се е наричала „витриолово масло“, но след това името се променя на витриолова киселина. През 17 -ти век Йохан Глаубер получава сярна киселина в резултат на изгарянето на калиев нитрат и естествена сяра в присъствието на водни пари. В резултат на окисляването на сярата с нитрат се получава серен оксид, който реагира с водни пари и в резултат се получава течност с мазна консистенция. Това беше масло от витриол и това име за сярна киселина съществува и до днес. Лондонският фармацевт Уорд Джошуа използва тази реакция за промишленото производство на сярна киселина през тридесетте години на 18 век, но през Средновековието консумацията й е ограничена до няколко десетки килограма. Обхватът на използване беше тесен: за алхимични експерименти, пречистване на благородни метали и във фармацията. Малки количества концентрирана сярна киселина бяха използвани за производството на специални кибрити, които съдържаха сол на бертолет. В Русия витриоловата киселина се появява едва през 17 век. В Бирмингам, Англия, Джон Роубак през 1746 г. адаптира горния метод за производство на сярна киселина и започва производство. При това той използва здрави, големи оловни камери, които са по -евтини от стъклени съдове. В промишлеността този метод запазва позициите си в продължение на почти 200 години и в камерите се получава 65% сярна киселина. С течение на времето английският Glover и френският химик Gay-Lussac подобриха самия процес и започна да се получава сярна киселина с концентрация 78%. Но за производството на например багрила такава киселина не е подходяща. В началото на 19 век са открити нови начини за окисляване на серен диоксид до серен анхидрид. Първоначално това беше направено с азотни оксиди, а след това платината беше използвана като катализатор. Тези два метода за окисляване на серен диоксид са доразвити. Окисляването на серен диоксид върху платина и други катализатори се нарича метод на контакт. Окисляването на този газ с азотни оксиди се нарича азотен метод за производство на сярна киселина. Британският търговец на оцетна киселина Перегрин Филипс патентова икономичен процес за производство на серен (VI) оксид и концентрирана сярна киселина едва през 1831 г. и именно той е известен на света днес като метод за контакт за неговото производство. Производството на суперфосфати започва през 1864 г. През осемдесетте години на деветнадесети век в Европа производството на сярна киселина достига 1 милион тона. Основните производители са Германия и Англия, произвеждащи 72% от общия обем на сярна киселина в света. Транспортирането на сярна киселина е трудоемко и отговорно начинание. Сярната киселина принадлежи към клас опасни химикали и при контакт с кожата причинява тежки изгаряния. Освен това може да причини химическо отравяне при хората. Ако по време на транспортирането не се спазват определени правила, сярната киселина поради своята експлозивност може да причини много вреди както на хората, така и на околната среда.
Сярната киселина е определена за клас на опасност 8 и трябва да се транспортира от специално обучени и обучени професионалисти. Важно условие за доставката на сярна киселина е спазването на специално разработените Правила за превоз на опасни товари. Транспортът по шосе се извършва в съответствие със следните правила:
Опасни свойства на сярна киселина за хоратаСярната киселина представлява повишена опасност за човешкото тяло. Токсичният му ефект се проявява не само при директен контакт с кожата, но и при вдишване на нейните пари, когато се отделя серен диоксид. Опасната експозиция се простира до:
Интоксикацията на организма може да бъде засилена от арсен, който често е част от сярна киселина. Важно! Както знаете, тежки изгаряния възникват, когато киселината влезе в контакт с кожата. Отравянето с изпарения на сярна киселина е не по -малко опасно. Безопасна доза сярна киселина във въздуха е само 0,3 mg на 1 квадратен метър. Ако сярна киселина попадне върху лигавиците или върху кожата, се появява тежко изгаряне, което не се лекува добре. Ако изгарянето е с впечатляващи мащаби, жертвата развива болест на изгаряне, която дори може да доведе до смърт, ако не се предостави своевременно квалифицирана медицинска помощ. Важно! За възрастен смъртоносната доза сярна киселина е само 0,18 cm3 на литър. Разбира се, проблематично е да се „изпита“ токсичният ефект на киселината в ежедневието. Най -често киселинното отравяне възниква поради пренебрегване на индустриалната безопасност при работа с разтвор.
Масово отравяне с изпарения на сярна киселина може да възникне поради технически неизправности при производството или невнимание и настъпва масово изпускане в атмосферата. За да се предотвратят подобни ситуации, работят специални служби, чиято задача е да контролират функционирането на производството, където се използва опасна киселина. Какви симптоми се наблюдават при интоксикация със сярна киселинаАко киселината е погълната:
При изгаряне на кожата могат да възникнат всички усложнения, присъщи на изгарянето. При отравяне с пари се наблюдава следната картина:
Важно е да знаете! Отравянето с киселини след поглъщане е много по -опасно от интоксикацията от вдишване на пари. Първа помощ и терапевтични процедури за поражение на сярна киселинаПри контакт със сярна киселина действайте както следва:
В болнични условия лечението ще зависи от зоната на изгаряне и степента на отравяне. Анестезията се извършва само с новокаин. За да се избегне развитието на инфекция в областта на инфекцията, пациентът се избира курс на антибиотична терапия. При стомашно кървене се инжектира плазма или се прелива кръв. Източникът на кървене може да бъде елиминиран чрез операция.
Предлагаме ви видео селекция от интересни експерименти със сярна киселина. Помислете за реакцията на сярна киселина, когато се излее в захар. В първите секунди, когато сярната киселина влезе в колбата със захар, сместа потъмнява. След няколко секунди веществото става черно. Следва забавната част. Масата започва да расте бързо и да се изкачва от колбата. На изхода получаваме гордо вещество, подобно на порест въглен, надвишаващо първоначалния обем с 3-4 пъти.
Авторът на видеото предлага сравнение на реакцията на Coca-Cola със солна киселина и сярна киселина. При смесване на Coca-Cola със солна киселина не се наблюдават визуални промени, но когато се смеси със сярна киселина, Coca-Cola започва да кипи.
Интересно взаимодействие може да се наблюдава, когато сярна киселина попадне върху тоалетна хартия. Тоалетната хартия е съставена от целулоза. Когато киселина удари, целулозната молекула се разрушава незабавно с освобождаването на свободен въглерод. Подобно овъгляване може да се наблюдава, когато киселина попадне върху дървото.
Добавям малко парче калий в колбата с концентрирана киселина. През първата секунда се отделя дим, след което металът моментално се разпалва, запалва се и експлодира, разчупвайки се на парчета.
В следващия експеримент, когато сярна киселина удари кибрит, тя се разпалва. Във втората част на експеримента се потапя алуминиево фолио с ацетон и кибрит вътре. Фолиото се загрява незабавно с отделянето на огромно количество дим и пълното му разтваряне.
Интересен ефект се наблюдава при добавяне на сода за хляб към сярна киселина. Содата веднага пожълтява. Реакцията протича с бурно кипене и увеличаване на обема.
Силно препоръчваме да не извършвате всички горепосочени експерименти у дома. Сярната киселина е много корозивно и токсично вещество. Такива експерименти трябва да се извършват в специални помещения, оборудвани с принудителна вентилация. Газовете, отделяни при реакции със сярна киселина, са много токсични и могат да причинят увреждане на дихателните пътища и отравяне на организма. В допълнение, подобни експерименти се провеждат в лични предпазни средства за кожата и дихателните органи. Пази се! Киселините са химични съединения, състоящи се от водородни атоми и киселинни остатъци, например SO4, SO3, PO4 и др. Те са неорганични и органични. Първите включват солна, фосфорна, сулфидна, азотна, сярна киселина. Към втория - оцетна, палмитинова, мравчена, стеаринова и др. Какво е сярна киселинаТази киселина се състои от два водородни атома и кисел остатък от SO4. Той има формулата H2SO4. Сярна киселина или, както я наричат също, сулфат, се отнася до неорганични кислородсъдържащи кисели киселини. Това вещество се счита за едно от най -агресивните и химически активни. В повечето химични реакции той действа като окислител. Тази киселина може да се използва в концентрирана или разредена форма, като в тези два случая има малко по -различни химични свойства. Физически свойстваСярната киселина при нормални условия има течно състояние, точката й на кипене е около 279,6 градуса по Целзий, точката на замръзване, когато се превърне в твърди кристали, е около -10 градуса за сто процента и около -20 за 95 процента.
Чистата стопроцентна сулфатна киселина е течно вещество без мирис и безцветно масло, което има почти двойна плътност на водата - 1840 кг / м3. Химични свойства на сулфатната киселинаСярната киселина реагира с метали, техните оксиди, хидроксиди и соли. Разреден с вода в различни пропорции, той може да се държи по различни начини, затова ще разгледаме по -подробно свойствата на концентриран и слаб разтвор на сярна киселина поотделно. Концентриран разтвор на сярна киселинаКонцентриран разтвор е разтвор, който съдържа 90 % сулфатна киселина. Такъв разтвор на сярна киселина може да реагира дори с ниско активни метали, както и с неметали, хидроксиди, оксиди и соли. Свойствата на такъв разтвор на сулфатна киселина са подобни на тези на концентрираната нитратна киселина.
Взаимодействие с металиПо време на химическата реакция на концентриран разтвор на сулфатна киселина с метали, разположени вдясно от водорода в електрохимичния ред метални напрежения (тоест с не най -активните), се образуват такива вещества: сулфат на метала, с който взаимодейства, вода и серен диоксид. Металите, в резултат на взаимодействие, с което се образуват изброените вещества, включват мед (купрум), живак, бисмут, сребро (аргентум), платина и злато (аурум).
Взаимодействие с неактивни металиС металите, които са вляво от водорода в серията напрежения, концентрираната сярна киселина се държи малко по -различно. В резултат на такава химическа реакция се образуват следните вещества: сулфат от определен метал, сероводород или чиста сяра и вода. Металите, с които протича такава реакция, включват също желязо (ферум), магнезий, манган, берилий, литий, барий, калций и всички останали, които са в серията напрежения вляво от водорода, с изключение на алуминий, хром, никел и титан - с тях концентрираната сулфатна киселина не взаимодейства. Взаимодействие с неметалиТова вещество е силно окислител, поради което може да участва в окислително-възстановителни химични реакции с неметали, като например въглерод (въглерод) и сяра. В резултат на такива реакции водата непременно се освобождава. Когато това вещество се добави към въглерода, се отделят също въглероден диоксид и серен диоксид. И ако добавим киселина към сярата, получаваме само серен диоксид и вода. При такава химическа реакция сулфатната киселина действа като окислител. Взаимодействие с органични веществаКарбонизацията може да бъде разграничена сред реакциите на сярна киселина с органични вещества. Този процес възниква, когато дадено вещество се сблъска с хартия, захар, влакна, дърво и т.н. В този случай въглеродът се отделя във всеки случай. Образуваният по време на реакцията въглерод може частично да реагира със сярна киселина в излишък от него. Снимката показва реакцията на захарта с разтвор на сулфатна киселина със средна концентрация.
Реакции със солиСъщо така, концентриран разтвор на H2SO4 реагира със сухи соли. В този случай възниква стандартна обменна реакция, при която се образуват метален сулфат, който присъства в структурата на солта, и киселина с остатък, който е бил в състава на солта. Концентрираната сярна киселина обаче не реагира със солеви разтвори. Взаимодействие с други веществаСъщо така, това вещество може да влезе в реакции с метални оксиди и техните хидроксиди, в тези случаи възникват реакции на обмен, в първия се отделят метален сулфат и вода, във втория - същото. Химични свойства на слаб разтвор на сулфатна киселинаРазредената сярна киселина реагира с много вещества и има същите свойства като всички киселини. Той, за разлика от концентрирания, взаимодейства само с активни метали, тоест тези, които са вляво от водорода в поредица от напрежения. В този случай протича същата реакция на заместване, както при всяка киселина. Това произвежда водород. Също така, такъв киселинен разтвор взаимодейства със солеви разтвори, в резултат на което протича обменна реакция, вече обсъдена по -горе, с оксиди - точно като концентрирани, с хидроксиди - по същия начин. В допълнение към обикновените сулфати има и хидросулфати, които са продукт на взаимодействието на хидроксид и сярна киселина.
Как да разберете дали разтворът съдържа сярна киселина или сулфатиЗа да се определи дали тези вещества присъстват в разтвора, се използва специална качествена реакция за сулфатни йони, която ви позволява да разберете. Състои се в добавяне на барий или негови съединения към разтвора. Това може да доведе до бяла утайка (бариев сулфат), която показва наличието на сулфати или сярна киселина. Как се добива сярна киселинаНай -разпространеният метод за промишлено производство на това вещество е извличането му от железен пирит. Този процес протича на три етапа, на всеки от които протича определена химическа реакция. Нека ги разгледаме. Първо, към пирита се добавя кислород, в резултат на което се образуват ферумен оксид и серен диоксид, който се използва за по -нататъшни реакции. Това взаимодействие се осъществява при високи температури. Следва етап, в който се получава серен триоксид чрез добавяне на кислород в присъствието на катализатор, който е ванадиев оксид. Сега, на последния етап, към полученото вещество се добавя вода, чрез което се получават сулфатни киселини. Това е най -често срещаният процес за промишлено производство на сулфатна киселина, той се използва най -често, тъй като пиритът е най -достъпната суровина, подходяща за синтеза на веществото, описано в тази статия. Сярна киселина, получена по този процес, се използва в различни индустрии - както в химическата, така и в много други, например, при рафинирането на нефт, добив на руда и др. Също така, нейното използване често се предвижда в технологията за производство на много синтетични влакна. .. Физични свойства на сярна киселина: Топлината на хидратация е толкова висока, че сместа може да заври, да се пръсне и да причини изгаряния. Следователно е необходимо да се добави киселина към водата, а не обратното, тъй като когато водата се добави към киселина, по -лека вода ще бъде на повърхността на киселината, където ще се концентрира цялата освободена топлина.
Промишлено производство на сярна киселина (метод на контакт):
2) 2SO 2 + O 2 V 2 O 5 → 2SO 3 3) nSO 3 + H 2 SO 4 → H 2 SO 4 nSO 3 (олеум) Натрошен пречистен мокър пирит (пирит) се изсипва отгоре в пещта за печене в " кипящ слой". Обогатен с кислород въздух се пропуска отдолу (принцип на противотока). В абсорбционната кула серен (VI) оксид се абсорбира от концентрирана сярна киселина. Химични свойства на сярна киселина:H 2 SO 4 е силна двуосновна киселина, една от най -силните минерални киселини, поради високата полярност, H - O връзката лесно се разрушава. 1)
Във воден разтвор сярната киселина се дисоциира
, образувайки водороден йон и киселинен остатък: 2) Взаимодействие на сярна киселина с метали: 3)
Реакция между сярна киселинас основни оксиди: 4)
Взаимодействие на сярна киселина схидроксиди: 5)
Обменни реакции със соли: Специални свойства на концентрирания H 2 SO 4:1) Концентриран сярна киселина е силен окислител ; при взаимодействие с метали (с изключение на Au, Pt), намалете до S +4 O 2, S 0 или H 2 S -2, в зависимост от активността на метала. Не реагира с Fe, Al, Cr без нагряване - пасивиране. При взаимодействие с метали с променлива валентност последните се окисляват до по -високи степени на окисление отколкото в случай на разреден киселинен разтвор: Fe 0→ Fe 3+, Cr 0→ Cr 3+, Mn 0→Mn 4+,Sn 0→ Sn 4+
Активен метал 8 Al + 15 H 2 SO 4 (конц.) → 4Al 2 (SO 4) 3 + 12H 2 O + 3 H 2 S 4Mg + 5H2SO4 → 4MgSO4 + H2S + 4H2O Метал със средна активност 2Cr + 4 H 2 SO 4 (конц.) → Cr 2 (SO 4) 3 + 4 H 2 O + С Неактивен метал 2Bi + 6H 2 SO 4 (конц.) → Bi 2 (SO 4) 3 + 6H 2 O + 3 SO 2
2Ag + 2H 2 SO 4 → Ag 2 SO 4 + SO 2 + 2H 2 O 2) Концентрираната сярна киселина окислява някои неметали, като правило, до максималното окислително състояние, самото се редуцира доS +4O 2: С + 2Н 2 SO 4 (конц) → CO 2 + 2SO 2 + 2H 2 O S + 2H 2 SO 4 (конц) → 3SO 2 + 2H 2 O 2P + 5H 2 SO 4 (конц.) → 5SO 2 + 2H 3 PO 4 + 2H 2 O 3) Окисляване на сложни вещества: Сярната киселина премахва химически свързаната вода от органични съединения, съдържащи хидроксилни групи. Дехидратацията на етилов алкохол в присъствието на концентрирана сярна киселина води до производството на етилен: Овъгляването на захар, целулоза, нишесте и други въглехидрати в контакт със сярна киселина се обяснява и с тяхната дехидратация:
|
Ново
- Сярна киселина: химични свойства, характеристики, производство на сярна киселина в производството
- Основните видове човешка дейност
- Конфронтацията на цивилизациите в културното наследство на Северозападната част на Русия: Новгородският период
- Полуживот на уран: основни характеристики и приложения Радиоактивен уран 235 92
- Транзакционният анализ като ефективна терапевтична техника в наркологията
- Атомното наследство на Сталин Какво е уран 235
- Методи на педагогическа дейност
- Местно, световно време, стандартно и лятно часово време За какво е лятното часово време?
- Класическата теория на гравитацията на Нютон
- Андрей Гейм, съвременен учен физик: биография, научни постижения, награди и награди










 1) 4FeS 2 + 11O 2 → 2Fe 2 O 3 + 8SO 2
1) 4FeS 2 + 11O 2 → 2Fe 2 O 3 + 8SO 2