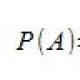Раздели на сайта
Избор на редакторите:
- Удостоверение за завършване на неделното училище (Toosh).
- Свети доктор-мъченик Евгений Боткин
- Страстоносец Евгений Боткин
- Как да се отървете от безпокойство, страх и тревога
- Какво представлява "наполеоновият комплекс" синдром на Наполеон в мъжката психология
- Евгени Боткин
- Женски глас: класификация, най-нисък и най-висок женски глас
- Как се променя животът след преживяването на просветление (пробуждане)?
- Основните точки на тестване
- Как да се отървете от страха от смъртта: съвети и психотерапевтична помощ
Реклама
| Без киселинен или основен оксид. Азотните оксиди и техните свойства. Химични свойства на амоняка |
| 30,0061 g/mol | |
| Физически свойства | |
|---|---|
| Състояние (ст. конв.) | безцветен газ |
| Плътност | 0,00134 (газ) g / cm³ |
| Топлинни свойства | |
| Температура на топене | −163,6 °C |
| Температура на кипене | −151,7 °C |
| Енталпия на образуване (ст. конв.) | 81 kJ / mol |
| Химични свойства | |
| Разтворимост във вода | 0,01 g / 100 ml |
| Класификация | |
| рег. CAS номер | |
Получаване
Азотният оксид (II) е единственият азотен оксид, който може да се получи директно от свободните елементи чрез комбиниране на азот с кислород при високи температури (1200-1300 ° C) или при електрически разряд. В природата се образува в атмосферата по време на мълниеносни разряди:
N 2 + O 2 → 2NO - 180,9 kJ 2NO + O 2 → 2NO 2.
С понижаване на температурата азотният оксид (II) се разлага на азот и кислород, но ако температурата падне рязко, тогава оксидът, който не е имал време да се разложи, съществува дълго време: при ниски температури скоростта на разлагане е ниска. Това гасене се нарича "гасене" и се използва в един от методите за производство на азотна киселина.
В лабораторията обикновено се получава чрез взаимодействие на 30% HNO 3 с определени метали, например с мед:
3Cu + 8HNO 3 (30%) → 3Cu (NO 3) 2 + 2NO + 4H 2 O.
Почистващ NO, замърсен с примеси, може да се получи чрез реакциите:
FeCl 2 + NaNO 2 + 2HCl → FeCl 3 + NaCl + NO + H 2 O; 2HNO 2 + 2HI → 2NO + I 2 ↓ + 2H 2 O.
Индустриалният метод се основава на окисляване на амоняк при висока температура и налягане с участието на Cr 2 O 3 (като катализатори):
4NH 3 + 5O 2 → 4NO + 6H 2 O.
Химични свойства
При стайна температура и атмосферно налягане оксидирането на NO от атмосферния кислород настъпва незабавно:
2NO + O 2 → 2NO 2
За NO също са характерни реакции на добавяне на халогени с образуване на нитрозилхалогениди; в тази реакция NO проявява свойствата на редуциращ агент:
2NO + Cl 2 → 2NOCl (нитрозил хлорид).
В присъствието на по-силни редуциращи агенти, NO проявява окислителни свойства:
2SO 2 + 2NO → 2SO 3 + N 2.
Във вода NO е слабо разтворим и не реагира с него, тъй като е оксид, който не образува сол.
Физиологично действие
Както всички азотни оксиди (с изключение на N 2 O), NO е токсичен и при вдишване засяга дихателните пътища.
През последните две десетилетия е установено, че тази молекула NO има широк спектър на биологично действие, което условно може да се раздели на регулаторно, защитно и вредно. NO, като един от пратениците, участва в регулирането на вътреклетъчните и междуклетъчни сигнални системи. Азотният оксид, произвеждан от съдовите ендотелни клетки, е отговорен за отпускането на съдовите гладки мускули и тяхното разширяване (вазодилатация), предотвратява агрегацията на тромбоцитите и адхезията на неврофилите към ендотела и участва в различни процеси в нервната, репродуктивната и имунната система. NO също има цитотоксични и цитостатични свойства. Клетките убийци на имунната система използват азотен оксид за убиване на бактерии и ракови клетки. Болести като есенциална артериална хипертония, исхемична болест на сърцето, инфаркт на миокарда, първична белодробна хипертония, бронхиална астма, невротична депресия, епилепсия, невродегенеративни заболявания (болест на Алцхаймер, болест на Паркинсон), захарен диабет и други, импотентност са свързани с нарушена метаболитна метаболитност на NO ....
Азотният оксид може да се синтезира по няколко начина. Растенията използват неензимна фотохимична реакция между NO 2 и каротеноидите. При животните синтезът се осъществява от семейството на NO синтазите (NOS). NOS ензимите са членове на хем-съдържащо суперсемейство ензими, наречени монооксигенази. В зависимост от структурата и функцията, NOS могат да бъдат разделени на три групи: ендотелни (eNOS), невронални (nNOS) и индуцирани (iNOS). Активното място на която и да е от NO синтазите включва железен порфиринов комплекс, съдържащ аксиално координиран цистеин или метионин. Въпреки че всички NOS изоформи катализират образуването на NO, всички те са продукти на различни гени, всеки от които има свои собствени характеристики, както по отношение на механизмите на действие и локализация, така и по отношение на биологичното значение за организма. Поради това е обичайно тези изоформи да се подразделят на конститутивна (cNOS) и индуцируема (iNOS) азотен оксид синтаза.
cNOS е постоянно в цитоплазмата, зависи от концентрацията на калциеви и калмодулинови йони (протеин, който е вътреклетъчен медиатор на транспорта на калциеви йони) и насърчава освобождаването на малко количество NO за кратък период от време в отговор на рецепторна стимулация. NOS се появява в клетките само след индуцирането им от бактериални ендотоксини и някои медиатори на възпалението, като гама-интерферон, тумор некрозис фактор и др. Количеството NO, образувано под влияние на iNOS, може да варира и да достига големи количества (наномоли). В същото време производството на NO продължава по-дълго време.
Характерна особеност на NO е способността бързо (за по-малко от 5 секунди) да дифундира през мембраната на клетката, която го синтезира, в междуклетъчното пространство и лесно (без участието на рецептори) да прониква в целевите клетки. Вътре в клетката той активира някои ензими и инхибира други, като по този начин участва в регулирането на клетъчните функции. По същество азотният монооксид е локален тъканен хормон. NO играе ключова роля в потискането на активността на бактериалните и туморните клетки, като блокира някои от техните желязосъдържащи ензими, или като уврежда клетъчните им структури с азотен оксид или свободни радикали, генерирани от азотен оксид. В същото време супероксидът се натрупва в огнището на възпалението, което причинява увреждане на протеините и липидите на клетъчните мембрани, което обяснява неговия цитотоксичен ефект върху целевата клетка. Следователно, NO, прекомерно натрупващ се в клетката, може да действа по два начина: от една страна, може да причини увреждане на ДНК и, от друга, може да има провъзпалителен ефект.
Азотният оксид е в състояние да инициира образуването на кръвоносни съдове. В случай на инфаркт на миокарда азотният оксид играе положителна роля, тъй като предизвиква нов съдов растеж, но при рак същият процес предизвиква развитието на тумори, допринасяйки за храненето и растежа на раковите клетки. От друга страна, това подобрява доставката на азотен оксид до туморните клетки. Увреждането на ДНК, причинено от NO, е една от причините за развитието на
Оксидите се наричат бинарни съединения на химични елементи с кислороден атом, в които степента на окисление е 2-. Азотът, който има по-ниска електроотрицателна стойност, образува различни комбинации с кислород. Тези съединения принадлежат към различни класове вещества. Азотният оксид съдържа кислород в количество, което определя валентността на елемента N. Тя варира от 1 до 5.
Какви са оксидите
Има около дузина азотни съединения, съдържащи О-елемента. От тях пет са най-често срещаните: едновалентен оксид, двувалентен оксид, тривалентен оксид, четиривалентен оксид и петвалентен азотен оксид.
Останалите връзки се считат за по-рядко срещани. Те включват четиривалентен азотен оксид под формата на димер, нестабилни молекули на нитрилазид, нитрозилазид, тринитрамид и нитратен радикал.
Формули на азотен оксид
По-долу са обозначенията на най-значимите съединения на елемент N.
Това е преди всичко азотен оксид, чиято формула се състои от два химически знака - N и O. Те са последвани от индекси, в зависимост от степента на окисление на атомите.
- Едновалентният азотен оксид има формулата N 2 O. В него N атомът е зареден +1.
- Азотният двувалентен оксид има формулата NO. В него N атомът е зареден +2.
- Азотният тривалентен оксид има формула N 2 O 3. В него N атомът е зареден +3.
- Четиривалентният азотен оксид, чиято формула е NO 2, има заряд на атома N +4.
- Петвалентното кислородно съединение е обозначено като N 2 O 5. В него N атомът е зареден +5.
Описание на едновалентен азотен оксид
Нарича се още диазот, азотен оксид и смеящ газ. Последното име идва от действие, свързано с интоксикация.

Азотният оксид с валентност I при нормални температурни условия съществува под формата на незапалим газ, безцветен, който проявява приятен сладникав вкус и мирис. Въздухът е по-лек от това съединение. Оксидът се разтваря във водна среда, етанол, етери и сярна киселина.
Водните, алкалните и киселинните разтвори не могат да реагират с него, не образува соли. Не се запалва, но е в състояние да поддържа процеса на горене.
Амонякът превръща азотния оксид в азид (N3NH4).
Когато се комбинират с молекули на етери, хлороетан и циклопропан, се образува експлозивна смес.
Нормалните условия го правят инертен. Веществото се редуцира чрез нагряване.
Описание на двувалентен азотен оксид
Нарича се още монооксиден, оксиден или нитрозилов радикал. При нормални температурни условия той е безцветен незапалим газ, слабо разтворим във водна среда. Той се окислява от въздуха, което води до NO 2. Течната и твърдата му форма става синя.

Азотният оксид може да бъде редуциращ агент при взаимодействия с халогени. Техният присъединителен продукт е нитрозилхалид, който има формула NOBr.
Серният диоксид и други силни редуциращи агенти окисляват NO, за да образуват N2 молекули.
Описание на тривалентен азотен оксид
Те се наричат азотен анхидрид. В нормално състояние той може да бъде течност, със син цвят, а стандартните параметри на околната среда превръщат оксида във формата на безцветен газ. Стабилен само при ниски температури.
Молекулите N 2 O 3 се дисоциират по време на нагряване с отделяне на моно- и двувалентен оксид.
Той добавя вода като анхидрид за получаване на азотна киселина и образува соли под формата на нитрити с основи.
Описание на четиривалентен азотен оксид
По друг начин се нарича диоксид. Той съществува под формата на кафяво-червен газ, който има остра миризма и може също да бъде жълтеникава течност.

Отнася се до киселинни оксиди, които имат добре развита химическа активност.
Неговите молекули окисляват неметалите, за да образуват кислород-съдържащи съединения и свободен азот.
Диоксидът взаимодейства с четиривалентен и шествалентен серен оксид. Оказва се сярна киселина. Методът на неговия синтез се нарича азотен.
Азотният оксид може да се разтвори във водна среда. Азотната киселина е резултат от тази реакция. Този процес се нарича диспропорциониране. Междинният компонент е азотна киселина, която бързо се разлага.
Ако разтворите четиривалентен азотен оксид в алкали, тогава се образуват разтвори на нитрати и нитрити. Можете да използвате неговата течна форма за взаимодействие с метала, след което получавате безводна сол.
Описание на петвалентен азотен оксид
Нарича се още диазотен пентоксид, нитрониев нитрат, нитрилен нитрат или азотен анхидрид.

Той съществува под формата на безцветни кристали, които са летливи и нестабилни. Тяхната стабилност се наблюдава при ниски температури. Тази структура се образува от нитратни и нитритни йони.
В газообразна форма веществото е под формата на NO 2 –O – NO 2 анхидрид.
Петвалентният азотен оксид има киселинни свойства. Лесно се разлага с отделянето на кислород.
Веществото реагира с вода, което води до азотна киселина.
Алкалните основи разтварят анхидрида с отделяне на нитратни соли.
Как се получават азотни оксиди
Азотният оксид N 2 O се образува при внимателно нагряване на амониев нитрат в суха форма, но този метод може да бъде придружен от експлозия.
Предпочитаният метод за получаване на едновалентен оксид е действието на концентрирана азотна киселина върху сулфамова киселина. Отоплението се счита за основно условие.
Нитрозил, или NO, е специален азотен оксид, произведен от взаимодействието на N 2 и O 2 молекули. Важно условие за този процес е силното нагряване над 1000 ° C.
Естественият метод на производство е свързан с мълниеносни разряди в атмосферния въздух. Този оксид бързо се комбинира с кислородни молекули, за да образува диоксид.
Лабораторният метод за синтез на NO е свързан с реакцията на метали и неконцентрирана азотна киселина. Пример за такава реакция би било взаимодействието на медта с HNO 3.
Друг начин за образуване на азотен монооксид е реакцията на железен хлорид с натриев нитрит и солна киселина. Процесът води до железо желязо и натриев хлорид, вода и самия оксид.
В индустриален мащаб се добива чрез окисляване на амонячни молекули по време на нагряване и под високо налягане. Ускорителят на процеса е платинен или хромов тривалентен оксид.
Диоксидът или NO 2 се получава чрез взаимодействието на тривалентен оксид арсен с 50% азотна киселина, която се нанася на капки върху повърхността на твърд реагент. Образува се смес от оксиди на двувалентен и четиривалентен азот.
Ако се охлади до температура от -30 ° C, тогава се синтезира азотен анхидрид или N 2 O 3.
В прахообразна форма се получава при преминаване на електрически ток през газообразната му форма.
Ако нишестето на прах се въздейства с азотна киселина с концентрация 50%, тогава се отделят двувалентен и четиривалентен азотен оксид, въглероден диоксид и вода. Впоследствие от получените първи две съединения се образува молекулата N 2 O 3.
В резултат на термично разлагане на оловното нитросъединение се отделят свободен кислород и оловен оксид.
Анхидридът или N 2 O 5 се образува поради елиминирането на водна молекула от киселина чрез азотно действие на фосфорен петвалентен оксид.
Друг начин за синтезирането му е преминаването на сух хлор през безводен сребърен нитрат.
Ако азотният диоксид се въздейства от молекули на озона, тогава се образува N 2 O 5.
Най-важните азотни оксиди са представени в таблица 1.
Азотният оксид (V) е твърдо вещество, другите оксиди са газообразни при нормални условия. От тях най-голямо практическо значение имат азотният оксид (II) и азотният оксид (IV). Всички азотни оксиди са отровни, с изключение на азотния оксид (I).
Азотен оксид (I) N 2 O.При стайна температура N 2 0 е безцветен газ (t pl = _ 91 ° C, t бала = -89 ° C), без мирис, сладникав на вкус, слабо разтворим във вода. При вдишване в малки количества N 2 0 предизвиква конвулсивен смях, поради което се нарича "газ за смях". Молекулата N 2 0 е линейна, с ниска полярност. По метода на валентните връзки неговата структура се описва с две резонансни структури:
Връзката между азотните атоми (0,113 nm) е само малко по-дълга от тройната връзка в N2 молекулата (0,110 nm).
Азотният оксид (1) се получава чрез термично разлагане на амониев нитрат при температура малко над точката му на топене (170 ° C):
NH 4 NO 3 → N 2 0 + 2H 2 0
По-чист N 2 0 се образува чрез съпропорциониране на нитрит и сол на хидразин или хидроксиламин:
NH 3 OHCI + NaN0 2 = N 2 O + 2H 2 0 + NaCl
Азотен оксид (II) NO- безцветен газ, слабо разтворим във вода и не взаимодейства химически с него. Лесно се комбинира с кислород, за да образува азотен оксид (IV):
2NO + O 2 → 2NO 2 + 113 kJ
Азотният оксид (II) се получава в лабораторията чрез действието на разредена азотна киселина (ρ = 1,2 g / cm 3, ω = 33%) върху медта. Уравнението на реакцията е:
3Cu + 8HNO 3 = 3Cu (NO 3) 2 + 2NO + 4H 2 O
Молекулата NO има нечетен брой външни електрони, следователно има един излишен електрон. Ненаситената природа на NO молекулата се проявява в способността й да комплексира с определени метални йони. Така, когато NO се прехвърли в разтвор на FeSO 4, последният става кафяв поради образуването на съединение от състава на SO 4. При нагряване това крехко съединение се разлага.
Азотният оксид (II) е типичен редуктор. Той обезцветява подкиселения разтвор на калиев перманганат:
5NO + 3KMn0 4 + 2H 2 S0 4 = 2MnS0 4 + 3KN0 3 + Mn (N0 3) 2 + 2H 2 0
лесно се окислява от кислород:
2NO + 0 2 = 2N0 2
Процесът протича с много висока скорост, тъй като и двете реагиращи частици са радикали.
Поради наличието на един несдвоен електрон в антисвързващата 2π-орбитала, азотният оксид (II) се характеризира с процесите на едноелектронно окисление с образуване на катион нитрозил (нитрозоний) N0 + : N0 - д - = N0 +. В този случай кратността на N-O връзката се увеличава до три, а енергията й се увеличава от 627 (NO) до 1046 (NO +) kJ / mol. Нитрозилните производни са ковалентни азотни оксихалиди NOX (X е халоген), както и йонни соли, например нитрозониев перхлорат, нитрозониев селенат (N0) 2 Se0 4. Нитрозониевият хидроген сулфат се получава чрез преминаване на серен диоксид през димяща азотна киселина:
HN0 3 + S0 2 =
Други нитрозониеви соли също могат да бъдат получени чрез взаимодействие на азотни оксиди с концентрирани киселини, например:
N 2 0 3 + H 2 Se0 4 = (N0) 2 Se0 4 + H 2 0
Нитрозониевите соли са термично нестабилни и в присъствието на вода необратимо хидролизират:
2 + H 2 0 = NO + N0 2 + 2H 2 S0 4
Ковалентен нитрозил хлорид N0C1 - оранжево-червен газ (т мн.ч= -65°C, t бала =-6 ° C), образуван по време на хлориране на NO в присъствието на активен въглен:
NO + C1 2 = 2N0C1
когато нитритът взаимодейства с хлороводород:
NaN0 2 + 2HC1 = N0C1 + NaCl + H 2 0
или при заместване на аниона в нитрозониеви соли:
NaCl = N0C1 + NaHS0 4
Окислителните свойства са по-малко характерни за NO. Например, при взаимодействие със силни редуциращи агенти се образува азот:
2N0 + 2H 2 S = N 2 + 2S ↓ + 2H 2 0
Върху родиев катализатор, NO окислява въглеродния оксид до въглероден диоксид:
2N0 + 2CO = N 2 + 2C0 2
Тези катализатори се монтират в изпускателните тръби на автомобилите, за да се избегне замърсяване на атмосферата с токсични NO x газове.
Когато взаимодейства с разтопена алкали, NO диспропорционира:
6N0 + 4KON = N 2 + 4KN0 2 + 2H 2 0
Азотен оксид (III) N 2 0 3.Това съединение е много нестабилно и съществува само при ниски температури. В твърдо и течно състояние (t pl = -100 ° C) това вещество е оцветено в ярко синьо; над O ° C се разлага:
N 2 0 3 = N0 + N0 2
За разлика от N 2 0 и NO, азотният оксид (II) е типичен кисел оксид; той се разтваря в ледена вода, за да образува син разтвор на азотна киселина;
N 2 0 3 + H 2 0 = 2HNO 2
При взаимодействие с алкални разтвори N 2 0 3 количествено се трансформира в нитрити:
N 2 0 3 + 2NaOH = 2NaN02 + H20
В силно кисела среда настъпва хетеролитично разлагане на връзката NO-NO 2, в резултат на което се образуват нитрозониеви соли:
N 2 0 3 + 3H 2 S0 4 = 2NO + + H 3 0 + + 3HSO 4
При охлаждане до -36 ° C еквимоларна смес от NO и NO 2 оксиди, образувана при редукция с 50% HNO 3 с арсен (III) оксид или нишесте, кондензира N 2 0 3:
2HN0 3 + As 2 0 3 + 2H 2 0 = 2H 3 As0 4 + N 2 0 3
1 / n (C 6 H 10 O 5) n + 12HN0 3 = 6C0 2 + 11H 2 0 + 6N 2 0 3
Азотни (IV) оксиди: NO 2 и N 2 0 4.Азотният оксид (IV) в широк температурен диапазон съществува под формата на равновесна смес от мономер NO 2 и димер N 2 0 4.
Равновесие
2N0 2 ↔ N 2 0 4, ΔН =-57,2 kJ / mol
Кафяв газ Безцветен газ
парамагнитен диамагнит
силно зависи от температурата. Твърдият азотен оксид (IV) е безцветен, тъй като се състои изключително от N 2 0 4 молекули. Когато се загрее до t, w= -12,8 ° C се появява кафяв цвят, който се увеличава с повишаване на температурата с увеличаване на съотношението на мономера в сместа.
Азотният оксид (IV) (както мономер, така и димер) е лесно разтворим във вода и взаимодейства с нея. Тъй като азотните съединения не съществуват в равни окислителни състояния във водни разтвори, се получава диспропорциониране на азотна и азотна киселина:
N 2 0 4 + H 2 0 = HN0 3 + HN0 2
Последното е стабилно само при студено време, а при стайна температура и над нея е непропорционално на N0 и HN0 3, поради което при стайна и по-висока температура реакцията протича по уравнението
3N0 2 + H 2 0 = 2HN0 3 + NO
Въпреки това, ако смес от N0 2 и въздух се пропусне през водата, тогава се образува само HN0 3:
2N0 2 + H 2 0 + 1/2 0 2 = 2HN0 3
Подобно на NO, оксидът N 2 0 4 подлежи на едноелектронно окисление с образуване на катион нитроил (нитроний) N0 2 , който има линейна структура и изоелектронен (16 e - за три атома) C0 2. Нитроиловият йон също се образува по време на самойонизацията на азотната киселина:
2HN0 3 ↔ N0 2 + + NO 3 - + H 2 0
Диоксидът NO 2 е силен окислител, в атмосферата на който горят въглерод, сяра и много метали:
C + 2N0 2 = C0 2 + 2NO
В газовата фаза азотният диоксид окислява хлороводорода до хлор:
2N0 2 + 4HC1 = 2NOC1 + 2H 2 0 + C1 2
N0 2 се получава при взаимодействието на мед с гореща концентрирана азотна киселина:
Cu + 4HN0 3 = Cu (N0 3) 2 + 2N0 2 + 2H 2 0
или чрез термично разлагане (350-500 °C) на внимателно изсушени нитрати на тежки метали:
2Pb (N0 3) 2 → 2PbO + 4N0 2 + 0 2
Реакцията се извършва в присъствието на силициев диоксид, който свързва образувания оловен оксид в силикат PbSiO 3, като по този начин измества равновесието надясно.
Азотният оксид (IV) също се образува по време на окисляването на NO с кислород:
2NO + 0 2 = 2N0 2, ΔН °= -114 kJ / mol
Интересното е, че тази реакция е обратима и при 200 ° C равновесието се измества значително наляво.
Азотен оксид (V) N 2 0 5.Азотният анхидрид N 2 0 5 се образува под формата на летливи (t subl = 32,3 ° C) безцветни хигроскопични кристали, когато парите на азотната киселина преминават през колона с фосфорен оксид (V):
4HN0 3 + Р 4 0 10 → 2N 2 0 5 + 4НР0 3
Твърдият N 2 0 5 е изграден от NO 2 + и N0 3 - йони, а в газовата фаза и в разтворите се състои от 0 2 N-O-N0 2 молекули. Това вещество е много нестабилно и се разлага в рамките на няколко часа (период на полуразпад 10 часа), при нагряване - с експлозия:
2N 2 0 5 = 4N0 2 + 0 2
Когато N 2 0 5 се разтваря във вода, се образува азотна киселина.
По-високият азотен оксид е силен окислител, например:
N 2 0 5 + I 2 = I 2 0 5 + N 2
В безводни киселини (сярна, азотна, ортофосфорна, перхлорна) N 2 0 5 се разлага, образувайки нитрониевия катион N0 2:
N 2 0 5 + НСlO 4 = N0 2 + C10 4 - + HN0 3
Нитрониеви соли са силни окислители. Когато се пуснат във вода, те хидролизират:
N0 2 + C10 4 - + H 2 0 = HN0 3 + HC10 4
Нитроилхлорид N0 2 C1 (t pl = -145 ° C, t бала = -16 ° C) е безцветен газ, образуван при преминаване на хлор върху твърд сребърен нитрат или при реакция на димяща азотна и хлорсулфонова киселини:
HN03 + ClSO3H = N02C1 + H2S04
В алкална среда се разлага на хипохлорит и нитрит.
Съдържанието на статията
АЗОТ, N (азот), химичен елемент (при номер 7) VA подгрупи на периодичната таблица на елементите. Земната атмосфера съдържа 78% (об.) азот. За да покажем колко големи са тези запаси от азот, нека отбележим, че има толкова много азот в атмосферата над всеки квадратен километър от земната повърхност, че до 50 милиона тона натриев нитрат или 10 милиона тона амоняк (съединение на азота с водород) може да се получи от него, но това представлява малка част от азота, съдържащ се в земната кора. Наличието на свободен азот показва неговата инертност и трудността на взаимодействието с други елементи при обикновени температури. Свързаният азот е част както от органична, така и от неорганична материя. Флората и фауната съдържат азот, свързан с въглерод и кислород в протеините. В допълнение, азотсъдържащи неорганични съединения са известни и могат да бъдат получени в големи количества, като нитрати (NO 3 -), нитрити (NO 2 -), цианиди (CN -), нитриди (N 3–) и азиди (N 3 - ).
Историческа справка.
Експериментите на А. Лавоазие, посветени на изследването на ролята на атмосферата в поддържането на живота и процесите на горене, потвърждават съществуването на относително инертно вещество в атмосферата. След като не успява да установи елементарната природа на газа, останал след изгарянето, Лавоазие го нарече азот, което на древногръцки означава "безжизнен". През 1772 г. Д. Ръдърфорд от Единбург установява, че този газ е елемент и го нарича "вреден въздух". Латинското наименование на азота идва от гръцките думи nitron и gen, което означава образуващ селитра.
Фиксиране на азот и азотен цикъл.
Терминът "азотна фиксация" означава процеса на фиксиране на атмосферния азот N 2. В природата това може да се случи по два начина: или бобовите растения, като грах, детелина и соя, натрупват възли по корените си, в които бактериите, фиксиращи азота, го превръщат в нитрати, или атмосферният азот се окислява от кислород при условия на мълния освобождаване от отговорност. С. Арениус установява, че по този начин се фиксират до 400 милиона тона азот годишно. В атмосферата азотните оксиди се комбинират с дъждовна вода, за да образуват азотна и азотна киселина. Освен това беше установено, че при дъжд и сняг ок. 6700 g азот; достигайки до почвата, те се превръщат в нитрити и нитрати. Растенията използват нитрати за образуване на растителни протеини. Животните, хранейки се с тези растения, усвояват протеиновите вещества на растенията и ги превръщат в животински протеини. След смъртта на животни и растения настъпва тяхното разлагане, азотните съединения се превръщат в амоняк. Амонякът се използва по два начина: бактерии, които не образуват нитрати, го разграждат до елементи, отделяйки азот и водород, а други бактерии образуват от него нитрити, които се окисляват от други бактерии до нитрати. По този начин азотният цикъл се случва в природата или азотният цикъл.
Структурата на ядрото и електронните обвивки.
В природата има два стабилни азотни изотопа: с масово число 14 (съдържа 7 протона и 7 неутрона) и с масово число 15 (съдържа 7 протона и 8 неутрона). Съотношението им е 99,635: 0,365, така че атомната маса на азота е 14,008. Нестабилни азотни изотопи 12 N, 13 N, 16 N, 17 N са получени изкуствено. Схематично електронната структура на азотния атом е както следва: 1 с 2 2с 2 2п х 1 2p y 1 2p z 1 . Следователно на външната (втора) електронна обвивка има 5 електрона, които могат да участват в образуването на химични връзки; азотните орбитали също могат да приемат електрони, т.е. образуването на съединения със степен на окисление от (–III) до (V) е възможно и те са известни.
Молекулен азот.
От определенията за плътността на газа се установи, че молекулата на азота е двуатомна, т.е. молекулната формула на азота е Nє N (или N 2). Два азотни атома имат три външни 2 стр-електроните на всеки атом образуват тройна връзка: N ::: N:, образувайки електронни двойки. Измереното междуатомно разстояние N – N е 1,095 Å. Както в случая с водорода ( см... ВОДОРОД), има азотни молекули с различни ядрени завъртания - симетрични и антисиметрични. При нормални температури съотношението на симетричните към антисиметричните форми е 2: 1. Известни са две модификации на азота в твърдо състояние: а- кубичен и б- шестоъгълна с преходна температура а ® б–237,39 ° C. Модификация бтопи се при -209,96 ° C и кипи при -195,78 ° C при 1 атм ( см... раздел. 1).
Енергията на дисоциация на мол (28,016 g или 6,023 × 10 23 молекули) молекулен азот в атоми (N 2 2N) е приблизително –225 kcal. Следователно атомният азот може да се образува по време на тих електрически разряд и е химически по-активен от молекулния азот.
Получаване и кандидатстване.
Методът за получаване на елементарен азот зависи от необходимата чистота. Азотът се получава в огромни количества за синтеза на амоняк, докато малки примеси на благородни газове са допустими.
Азот от атмосферата.
Икономически освобождаването на азот от атмосферата се дължи на евтиността на метода за втечняване на пречистения въздух (отстраняват се водна пара, CO 2, прах и други примеси). Последователните цикли на компресиране, охлаждане и разширяване на такъв въздух водят до неговото втечняване. Течният въздух се подлага на фракционна дестилация с бавно повишаване на температурата. Първо се отделят благородни газове, след това азот и остава течен кислород. Пречистването се постига чрез множество процеси на фракциониране. Този метод произвежда много милиони тонове азот годишно, главно за синтеза на амоняк, който е суровина в технологията за производство на различни азотсъдържащи съединения за промишлеността и селското стопанство. Освен това често се използва пречистена азотна атмосфера, когато присъствието на кислород е неприемливо.
Лабораторни методи.
Малки количества азот могат да бъдат получени в лабораторията по различни начини, чрез окисляване на амоняк или амониев йон, например:
Процесът на окисляване на амониевия йон от нитритния йон е много удобен:
Известни са и други методи - разлагане на азиди при нагряване, разлагане на амоняк с меден (II) оксид, взаимодействие на нитрити със сулфамова киселина или урея:
По време на каталитичното разлагане на амоняка при високи температури може да се получи и азот:
Физически свойства.
Някои от физичните свойства на азота са дадени в табл. 1.
| Таблица 1. НЯКОИ ФИЗИЧЕСКИ СВОЙСТВА НА АЗОТА | |
| Плътност, g / cm 3 | 0,808 (течност) |
| Точка на топене, °С | –209,96 |
| Точка на кипене, °С | –195,8 |
| Критична температура, °С | –147,1 |
| Критично налягане, атм | 33,5 |
| Критична плътност, g / cm 3 a | 0,311 |
| Специфична топлина, J / (molChK) | 14,56 (15°C) |
| Електроотрицателност по Полинг | 3 |
| Ковалентен радиус, | 0,74 |
| Кристален радиус, | 1,4 (M 3–) |
| Йонизационен потенциал, V b | |
| първо | 14,54 |
| второ | 29,60 |
| a Температура и налягане, при които плътностите на течния и газообразния азот са еднакви. b Количеството енергия, необходимо за отстраняване на първия външен и следващите електрони, на 1 мол атомен азот. |
|
Химични свойства.
Както вече беше отбелязано, преобладаващото свойство на азота при нормални условия на температура и налягане е неговата инертност или ниска химическа активност. Електронната структура на азота съдържа електронна двойка за 2 с-ниво и три наполовина запълнени 2 Р-орбитали, така че един азотен атом може да свърже не повече от четири други атома, т.е. координационният му номер е четири. Малкият размер на атома също ограничава броя на атомите или групите от атоми, които могат да бъдат свързани с него. Следователно много съединения от други членове на подгрупата VA или изобщо нямат аналози сред азотните съединения, или аналогичните азотни съединения са нестабилни. По този начин PCl 5 е стабилно съединение, докато NCl 5 не съществува. Един азотен атом е в състояние да се свърже с друг азотен атом, образувайки няколко доста стабилни съединения, като хидразин N 2 H 4 и метални азиди MN 3. Този тип връзка е необичайна за химичните елементи (с изключение на въглерода и силиция). При повишени температури азотът реагира с много метали, за да образува частично йонни нитриди M хн г... В тези съединения азотът е отрицателно зареден. Таблица 2 показва степените на окисление и примери за съответните съединения.
нитриди.
Азотните съединения с повече електроположителни елементи, метали и неметали - нитриди - са подобни на карбидите и хидридите. Те могат да бъдат разделени, в зависимост от естеството на връзката M – N, на йонни, ковалентни и с междинен тип връзка. По правило това са кристални вещества.
Йонни нитриди.
Връзката в тези съединения включва прехвърляне на електрони от метал към азот с образуването на йон N 3–. Тези нитриди включват Li3N, Mg3N2, Zn3N2 и Cu3N2. В допълнение към лития, други алкални метали IA не образуват нитридната подгрупа. Йонните нитриди имат високи точки на топене и реагират с вода, за да образуват NH3 и метални хидроксиди.
Ковалентни нитриди.
Когато азотните електрони участват в образуването на връзка заедно с електроните на друг елемент, без да ги прехвърлят от азот към друг атом, се образуват нитриди с ковалентна връзка. Водородните нитриди (напр. амоняк и хидразин) са напълно ковалентни, както и азотните халогениди (NF 3 и NCl 3). Ковалентните нитриди включват например Si 3 N 4, P 3 N 5 и BN - силно стабилни бели вещества, а BN има две алотропни модификации: хексагонална и диамантена. Последният се образува при високи налягания и температури и има твърдост, близка до тази на диаманта.
Нитриди с междинен тип връзка.
Преходните елементи реагират с NH 3 при високи температури, за да образуват необичаен клас съединения, в които азотните атоми са разпределени между равномерно разположени метални атоми. Няма ясно изместване на електроните в тези съединения. Примери за такива нитриди са Fe 4 N, W 2 N, Mo 2 N, Mn 3 N 2. Тези съединения обикновено са напълно инертни и имат добра електрическа проводимост.
Водородни съединения на азота.
Азотът и водородът взаимодействат, за да образуват съединения, които смътно наподобяват въглеводороди. Стабилността на водородния азот намалява с увеличаване на броя на азотните атоми във веригата, за разлика от въглеводородите, които също са стабилни в дългите вериги. Най-важните водородни нитриди са амоняк NH3 и хидразин N2H4. Те включват също хидразоена киселина HNNN (HN 3).
Амоняк NH3.
Амонякът е един от най-важните промишлени продукти на съвременната икономика. В края на 20 век. САЩ произвеждат прибл. 13 милиона тона амоняк годишно (по отношение на безводен амоняк).
Структура на молекулата.
Молекулата NH 3 има почти пирамидална структура. Връзният ъгъл H – N – H е 107 °, което е близко до тетраедричния ъгъл от 109 °. Несподелена електронна двойка е еквивалентна на прикрепена група; в резултат на това координационният номер на азота е 4 и азотът се намира в центъра на тетраедъра.
Свойства на амоняк.
Някои от физичните свойства на амоняка в сравнение с водата са дадени в табл. 3.
Точките на кипене и топене на амоняка са много по-ниски от тези на водата, въпреки близостта на молекулните тегла и сходството на молекулната структура. Това се дължи на относително по-високата якост на междумолекулните връзки във водата, отколкото в амоняка (тази междумолекулна връзка се нарича водород).
Амоняк като разтворител.
Високата диелектрична константа и диполен момент на течния амоняк го позволяват да се използва като разтворител за полярни или йонни неорганични вещества. Амонячният разтворител е междинен продукт между вода и органични разтворители като етилов алкохол. Алкалните и алкалоземните метали се разтварят в амоняк, образувайки тъмносини разтвори. Може да се приеме, че солватацията и йонизацията на валентни електрони протича в разтвора по схемата
Синьото е свързано с разтварянето и движението на електроните или с подвижността на "дупките" в течност. При висока концентрация на натрий в течен амоняк, разтворът придобива бронзов цвят и има висока електрическа проводимост. Несвързаният алкален метал може да бъде извлечен от такъв разтвор чрез изпаряване на амоняк или добавяне на натриев хлорид. Разтворите на метали в амоняк са добри редуциращи агенти. Автойонизацията се случва в течен амоняк
подобен на процеса, протичащ във вода:
Някои химични свойства на двете системи са сравнени в табл. 4.
Течният амоняк като разтворител е изгоден в някои случаи, когато е невъзможно да се проведат реакции във вода поради бързото взаимодействие на компонентите с вода (например окисляване и редукция). Например, в течен амоняк, калцият реагира с KCl, за да образува CaCl 2 и K, тъй като CaCl 2 е неразтворим в течен амоняк, а K е разтворим и реакцията протича напълно. Във вода такава реакция е невъзможна поради бързото взаимодействие на Са с вода.
Получаване на амоняк.
Газообразният NH 3 се освобождава от амониеви соли под действието на силна основа, например NaOH:
Методът е приложим в лабораторни условия. Дребномащабното производство на амоняк също се основава на хидролизата на нитриди, например Mg 3 N 2, с вода. Калциевият цианамид CaCN 2, когато взаимодейства с вода, също образува амоняк. Основният индустриален метод за производство на амоняк е неговият каталитичен синтез от атмосферен азот и водород при високи температури и налягания:
Водородът за този синтез се получава чрез термичен крекинг на въглеводороди, действие на водна пара върху въглища или желязо, разлагане на алкохоли с водна пара или електролиза на вода. Получени са много патенти за синтеза на амоняк, различаващи се по условията на процеса (температура, налягане, катализатор). Съществува метод за промишлено производство чрез термична дестилация на въглища. Имената на Ф. Габер и К. Бош се свързват с технологичното развитие на синтеза на амоняк.
| Таблица 4. СРАВНЕНИЕ НА РЕАКЦИИ ВЪВ ВОДНА И АМОНИЯЧНА СРЕДА | |
| Водна среда | Амонячна среда |
| Неутрализиране | |
| OH - + H 3 O + ® 2H 2 O | NH 2 - + NH 4 + ® 2NH 3 |
| Хидролиза (протолиза) | |
| PCl 5 + 3H 2 O POCl 3 + 2H 3 O + + 2Cl - | PCl 5 + 4NH 3 PNCl 2 + 3NH 4 + + 3Cl - |
| Заместване | |
| Zn + 2H 3 O + ® Zn 2+ + 2H 2 O + H 2 | Zn + 2NH 4 + ® Zn 2+ + 2NH 3 + H 2 |
| Хидратация (комплексиране) | |
| Al 2 Cl 6 + 12H 2 O 2 3+ + 6Cl - | Al 2 Cl 6 + 12NH 3 2 3+ + 6Cl - |
| Амфотерност | |
| Zn 2+ + 2OH - Zn (OH) 2 | Zn 2+ + 2NH 2 - Zn (NH 2) 2 |
| Zn (OH) 2 + 2H 3 O + Zn 2+ + 4H 2O | Zn (NH 2) 2 + 2NH 4 + Zn 2+ + 4NH 3 |
| Zn (OH) 2 + 2OH - Zn (OH) 4 2– | Zn (NH 2) 2 + 2NH 2 - Zn (NH 2) 4 2– |
Химични свойства на амоняка.
В допълнение към реакциите, посочени в табл. 4, амонякът реагира с вода, за да образува съединението NH3CHH2O, което често погрешно се смята, че е амониев хидроксид NH4OH; всъщност съществуването на NH 4 OH в разтвор не е доказано. Воден разтвор на амоняк ("амоняк") се състои главно от NH 3, H 2 O и малки концентрации на NH 4 + и OH - йони, образувани по време на дисоциацията
Основният характер на амоняка се обяснява с наличието на самотна електронна двойка азот: NH3. Следователно NH 3 е база на Люис, която има по-висока нуклеофилна активност, проявяваща се под формата на връзка с протон или ядро на водороден атом:
Всеки йон или молекула, способни да приемат електронна двойка (електрофилно съединение), ще реагира с NH3, за да образува координационно съединение. Например:
Символ М н+ представлява йон на преходен метал (В-подгрупи на периодичната таблица, например Cu 2+, Mn 2+ и др.). Всяка протонова (т.е. съдържаща Н) киселина реагира с амоняк във воден разтвор за образуване на амониеви соли като амониев нитрат NH 4 NO 3, амониев хлорид NH 4 Cl, амониев сулфат (NH 4) 2 SO 4, фосфат амоний (NH 4) 3 PO 4. Тези соли се използват широко в селското стопанство като торове за въвеждане на азот в почвата. Амониевият нитрат се използва и като евтин експлозив; за първи път е използван с мазут (дизелово гориво). Воден разтвор на амоняк се използва директно за въвеждане в почвата или с вода за напояване. Урея NH 2 CONH 2, получена чрез синтез от амоняк и въглероден диоксид, също е тор. Газообразният амоняк реагира с метали като Na и K, за да образува амиди:
Амонякът реагира с хидриди и нитриди, за да образува амиди:
Амидите на алкални метали (напр. NaNH2) реагират с N2O при нагряване, за да образуват азиди:
Газообразният NH 3 редуцира оксидите на тежките метали до метали при високи температури, очевидно поради водорода, образуван в резултат на разлагането на амоняка в N 2 и H 2:
Водородните атоми в молекулата на NH 3 могат да бъдат заменени с халоген. Йодът реагира с концентриран разтвор на NH3, за да образува смес, съдържаща NI3. Това вещество е много нестабилно и експлодира при най-малкото механично въздействие. Когато NH3 реагира с Cl2, се образуват хлорамини NCl3, NHCl2 и NH2Cl. Когато амонякът е изложен на натриев хипохлорит NaOCl (образуван от NaOH и Cl 2), крайният продукт е хидразин:
Хидразин.
Горните реакции представляват метод за получаване на хидразин монохидрат със състав N 2 H 4 CH H 2 O. Безводният хидразин се получава чрез специална дестилация на монохидрата с BaO или други дехидратиращи вещества. По отношение на свойствата хидразинът малко наподобява водороден прекис H 2 O 2. Чистият безводен хидразин е безцветна хигроскопична течност, кипяща при 113,5 ° C; добре разтворим във вода, образувайки слаба основа
В кисела среда (H +) хидразинът образува разтворими хидразониеви соли от + X - тип. Лекотата, с която хидразинът и някои от неговите производни (например метилхидразин) реагират с кислород, позволява да се използва като компонент на течното гориво. Хидразинът и всички негови производни са силно токсични.
Азотни оксиди.
В съединения с кислород азотът проявява всички степени на окисление, образувайки оксиди: N 2 O, NO, N 2 O 3, NO 2 (N 2 O 4), N 2 O 5. Има оскъдна информация за образуването на азотни пероксиди (NO 3, NO 4). 2HNO 2. Чист N 2 O 3 може да се получи като синя течност при ниски температури (-20
При стайна температура NO 2 е тъмнокафяв газ, който има магнитни свойства поради наличието на несдвоен електрон. При температури под 0 ° C молекулата NO 2 димеризира до двуазотен тетроксид, а при –9,3 ° C димеризацията протича напълно: 2NO 2 N 2 O 4. В течно състояние само 1% NO 2 е недимеризиран и при 100 ° C остава под формата на димер от 10% N 2 O 4.
NO 2 (или N 2 O 4) реагира в топла вода, за да образува азотна киселина: 3NO 2 + H 2 O = 2HNO 3 + NO. Следователно технологията NO 2 е много важна като междинен етап в производството на индустриално важен продукт - азотна киселина.
азотен оксид (V)
N 2 O 5 ( остаряла... анхидрид на азотна киселина) - бяло кристално вещество, получено чрез дехидратация на азотна киселина в присъствието на фосфорен оксид P 4 O 10:
2MX + H 2 N 2 O 2. При изпаряване на разтвора се получава бял експлозив с предполагаемата структура H – O – N = N – O – H.Азотна киселина
HNO 2 не съществува в чиста форма, но водни разтвори с ниска концентрация се образуват при добавяне на сярна киселина към бариев нитрит:
Азотната киселина също се образува чрез разтваряне на еквимоларна смес от NO и NO 2 (или N 2 O 3) във вода. Азотната киселина е малко по-силна от оцетната киселина. Степента на окисление на азота в него е +3 (структурата му е H – O – N = O); може да бъде както окислител, така и редуциращ агент. Под действието на редуциращи агенти обикновено се редуцира до NO, а при взаимодействие с окислители се окислява до азотна киселина.
Скоростта на разтваряне на някои вещества, например метали или йодиден йон, в азотна киселина зависи от концентрацията на азотна киселина, присъстваща като примес. Солите на азотната киселина - нитритите - са лесно разтворими във вода, с изключение на сребърния нитрит. NaNO 2 се използва при производството на багрила.
Азотна киселина
HNO 3 е един от най-важните неорганични продукти на масовата химическа промишленост. Използва се в технологиите на много други неорганични и органични вещества, например експлозиви, торове, полимери и влакна, багрила, фармацевтични продукти и др.
литература:
Наръчник на Азотчик... М., 1969 г
Б. В. Некрасов Основи на общата химия... М., 1973 г
Проблеми с азотфиксацията. Неорганична и физическа химия... М., 1982г
Въведение
Ако погледнете отблизо азота в периодичната таблица на химичните елементи на Д. И. Менделеев, ще забележите, че той има променлива валентност. Това означава, че азотът образува няколко бинарни съединения с кислород наведнъж. Някои от тях са открити наскоро, а някои са изследвани надлъж и нашир. Има нестабилни и стабилни азотни оксиди. Химичните свойства на всяко от тези вещества са напълно различни, следователно при изучаването им трябва да се вземат предвид поне пет азотни оксида. Това са темите, които ще бъдат обсъдени в днешната статия.
азотен оксид (I)
Формулата е N 2 O. Понякога може да се нарече азотен оксонитрид, динитрогенен оксид, азотен оксид или смеящ газ.
Имоти
При нормални условия той се представя от безцветен газ със сладникава миризма. Може да се разтвори с вода, етанол, етер и сярна киселина. Ако газообразният едновалентен азотен оксид се нагрява до стайна температура под налягане от 40 атмосфери, той се сгъстява до безцветна течност. Това е оксид, който не образува сол, който се разлага при нагряване и се проявява в реакции като редуциращ агент.
Получаване
Този оксид се образува при сухо нагряване.Друг начин за получаването му е термичното разлагане на смес от "сулфаминова + азотна киселина".
Приложение
Използван като инхалационен анестетик, хранително-вкусовата промишленост познава този оксид като добавка E942. Освен това подобрява техническите характеристики на двигателите с вътрешно горене.
азотен оксид (II)

Формула - НЕ. Среща се под имената на азотен монооксид, азотен оксид и нитрозилов радикал
Имоти
При нормални условия той изглежда като безцветен газ, който е слабо разтворим във вода. Трудно се втечнява, но е синя в твърдо и течно състояние. Този оксид може да се окисли от атмосферния кислород.
Получаване
Получаването му е доста лесно, за това трябва да загреете смес от азот и кислород до 1200-1300 ° C. В лабораторни условия се образува наведнъж в няколко експеримента:
- Реакция на мед и 30% разтвор на азотна киселина.
- Реакция между натриев нитрит и солна киселина.
- Реакция на азотна и йодоводородна киселина.
Приложение
Това е едно от веществата, от които се получава азотна киселина.
азотен оксид (III)

Формула - N 2 O 3. Може да се нарече още азотен анхидрид и азотен полуокис.
Имоти
При нормални условия това е течност със син цвят, а при стандартни условия е безцветен газ. Чистият оксид съществува само в твърдо агрегатно състояние.
Получаване
Образува се при взаимодействието на 50% азотна киселина и твърд оксид на тривалентен арсен (може да бъде заменен и с нишесте).
Приложение
С помощта на това вещество в лаборатории се получават неговите соли.
азотен оксид (IV)

Формула - NO 2. Може да се нарече още азотен диоксид или кафяв газ.
Имоти
Фамилното име отговаря на едно от свойствата му. В крайна сметка този оксид има формата на червено-кафяв газ или жълтеникава течност. Характеризира се с висока химическа активност.
Получаване
Този оксид се получава при взаимодействието на азотна киселина и мед, както и при термично разлагане на оловен нитрат.
Приложение
С негова помощ се произвеждат течни и смесени сярна и азотна киселини
азотен оксид (V)

Формула - N 2 O 5. Може да се нарича диазотен пентоксид, нитроил нитрат или азотен анхидрид.
Имоти
Има вид на безцветни и силно летливи кристали. Те могат да се топят при температура от 32,3 ° C.
Получаване
Този оксид се образува от няколко реакции:
- Дехидратация на азотна киселина с петвалентен фосфорен оксид.
- Преминаване на сух хлор
- Взаимодействие на озона с четиривалентен азотен оксид.
Приложение
Поради изключителната си нестабилност, не се използва никъде в чист вид.
Заключение
В химията има девет азотни оксида, горните са само класическите съединения на този елемент. Другите четири са, както вече споменахме, нестабилни вещества. Всички те обаче са обединени от едно свойство - висока токсичност. Емисиите на азотни оксиди в атмосферата водят до влошаване на здравето на хората, живеещи в близост до промишлени химически заводи. Симптомите на отравяне с някое от тези вещества са токсичен белодробен оток, разстройство на централната нервна система и увреждане на кръвта, причината за което е свързването на хемоглобина. Следователно с азотните оксиди трябва да се работи внимателно и в повечето случаи трябва да се използват защитни средства.
| Прочети: |
|---|
Популярен:
Каква е равновесната константа
|
Нов
- Забележителности на Лондон на английски: описание и снимки Характеристики за описание на обекта
- Правила за добавяне
- Основни форми на поздрави (превод Nihao)
- Фразов глагол TURN, изрази и идиоми
- BelZhD има онлайн табло
- Какво е ускорение? Скорост. ускорение Тялото се ускорява, ако
- Шаблони на менюта в Word: изтегляне и отпечатване
- Проста математика на теоремата на Байес
- Критерий за корелация на Пиърсън Коефициент на корелация 1 означава
- Размити и произволни множества Основни еквивалентности на пропозиционалната алгебра