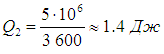Sitenin bölümleri
Editörün Seçimi:
- Eski hükümdar. Hükümdarın mahmuzu. Saul'un kral olarak seçilmesi
- 1812 Vatanseverlik Savaşı'ndaki partizanların sakalı
- Volyn Can Muhafızları Alayı, alay listelerinde listelendi
- Ordudaki muhafız birimleri: vakıf, tarih
- Rusya'nın askeri zafer günü - Borodino Savaşı Günü
- Gizli ofis liderlerinin biyografileri
- Sergei Platonov, Rus tarihi üzerine tam ders dersi
- Sergei Platonov - Rus tarihi üzerine tam bir ders
- Besleme sistemini kim iptal etti
- Mordovya Cumhuriyeti Tarihi
reklam
| Carnot çevrimi entropi artışı. Entropi. Termodinamiğin ikinci yasası. Termal ve soğutma makineleri. Carnot çevrimi ve verimliliği. Alınan malzemeyi ne yapacağız? |
|
Fizik üzerine dersler. Moleküler fizik ve termodinamiğin temelleri Termodinamiğin ikinci yasası. Termal motorlar. Entropi. Carnot çevrimi Tersinir ve tersinmez süreçler Tersinir bir süreç, sistemin herhangi bir işlem yapmadan orijinal durumuna dönmesine izin veren bir süreçtir. Çevre bazı değişiklikler vardır Sadece bir denge süreci tersine çevrilebilir, ancak her denge süreci tersine çevrilemez 2 Tersinir ve geri döndürülemez süreçler Örnek. Üzerine ağırlık konulan bir pistonun altındaki bir silindirdeki gaz sistemini ele alalım. Gaz genişleyecektir. Gazı orijinal konumuna geri döndürmek için, A=Mgh işini yaptıktan sonra yükü h yüksekliğine kaldırmak ve pistona takmak gerekir. Şimdi, gazı ilk durumuna genişletmek ve sıkıştırmak için, işi genişletmek gerekir A=Mgh/2 Eğer pistonu sonsuz küçük mesafeler boyunca hareket ettirirsek, o zaman tersinir bir süreç elde ederiz M/2 h M /2 M/2 M/2 M/2 M/2 M/2 4 Tersinir ve tersinmez süreçler Tersinir olmayan bir denge süreci örneği ısı transferidir Tersinmez dairesel süreçlerin uygulanması için tazminat, enerjinin bir biçimden diğerine transferidir . Bu, çeşitli enerji biçimlerinin eşdeğer olmadığını gösterir.Termal enerji, diğer enerji türlerinden daha az değerlidir. Bu, termal süreçlerin yönünü varsaymaktadır Clausius'un formülasyonu: Isı, daha az ısıtılmış bir cisimden daha sıcak bir cisime kendiliğinden transfer olamaz.6 Termodinamiğin ikinci yasası Thomson'ın formülasyonu. Tek sonucu ısıl rezervuarın soğutulması nedeniyle iş performansı olacak dairesel bir işlem mümkün değildir.Bu işlemin gerçekleştirilmesini sağlayacak cihaza ikinci tür sürekli hareket makinesi denir. Etc'nin ikinci yasasından ikinci türden sürekli hareket makinesine bir yasak getirir. çevrim yöntemini ve termodinamik fonksiyonlar yöntemini kullanarak birçok özel sonuç elde edebilirsiniz. 8 Isı motorları Bir ısı motoru, döngüsel bir T.D. proses Herhangi bir ısı motorunda, ısı, ısıtıcıdan çalışma sıvısına ve ardından soğutucuya aktarılır. Bu durumda faydalı iş yapılır Isıtıcı Q1 Çalışma sıvısı Q2 Buzdolabı A 9 Isı motorları 10 Çevrim yöntemi Döngüsel bir süreçte U=0 Q=A=Q1-Q2 12 geçişinde sistem tarafından iş yapılır ve 21 geçişinde iş yapılır sistemin üstünde 1 "2' geçişinde sisteme ısı aktarılır ve sistemden 2"1" geçerken ısı motorunun verimi =A/Q1=(Q1-Q2)/Q1 P Adiabats Q1 2" 1 1" Q2 2 V 11 Carnot çevrimi Carnot çevrimi iki izoterm ve iki adyabatikten oluşur Adyabatik ve izotermal süreçlerdeki ısı kapasiteleri çalışma sıvısına bağlı değildir, bu nedenle bunların dikkate alınması bir dizi genel modeli ortaya çıkarmamıza izin verir P Adiabat İzotermleri Q1 T1 Q2 T2 V 12 Carnot çevrimi Birinci Carnot teoremi: Carnot çevrimine göre çalışan bir ısı motorunun verimi sadece ısıtıcı ve soğutucunun sıcaklığına bağlıdır ve makinenin aygıtına ve çalışma akışkanının tipine bağlı değildir. (V3/V4) =A/Q1=/RT1ln(V2/V1) Adyabatik denklemden: TV-1=c onst P V1 Q1 Т1 V2 Q2 V4 Т2 V3 V 14 Karnot çevrimi T1V1-1= T2V4-1 ve T1V2-1= T2V3-1 V2/V1=V3/V4 =(T1-T2)/T1=1-T2/T1 Verimliliği artırmak için ısıtıcının sıcaklığını artırmak ve buzdolabının sıcaklığını düşürmek gerekir =(Q1-Q2)Q1=(T1-T2)/T1 Q1/T1=Q2/T2 Q/T miktarı azaltılmış ısı 15 Carnot çevrimi İkinci Carnot teoremi: herhangi bir çevrimin verimliliği Carnot çevriminin verimliliğinden daha büyük olamaz - =1T2/T1, burada T1 maksimum sıcaklık ve T2 minimum sıcaklıktır PV 16 Entropi Rastgele bir düşünün denge döngüsü. Küçük Carnot döngüleri ile yaklaşık olarak hesaplıyoruz.Her K döngüsü için şunu yazabiliriz: Q1i/T1i-Q2i/T2i=0 Tüm döngülerin toplamını alırsak, şunu elde ederiz: Qk/Tk=0 Т.о. dQ/T'nin bazı T.D.'lerin diferansiyeli olduğunu elde ederiz. fonksiyonlar Bu fonksiyona entropi diyelim P V 17 Entropi Entropi, diferansiyeli tersinir bir süreçte temel ısı etkisi ile şu bağıntıyla ilgili olan böyle bir durum fonksiyonudur: dQ=TdS () şu şekilde ifade edilebilir: TdS=dU+PdV parametreler 18 Entropi Bir ideal gazın entropisini bulalım dU=cVdT ve P/T=R/V'den şu sonuç çıkar: dS=cVdT/T+RdV/VS(T,V)=cVlnT+RlnV cV=const S ile T ve P cinsinden ifade edilebilir: S(T,P)=cPlnT-RlnP 19 Entropi Entropinin ısı cinsinden tanımı bir zorluğu karşılar. T=0 noktasında, integral dQ/T ıraksayabilir.Bu belirsizlik, bazen termodinamiğin üçüncü yasası olarak adlandırılan Nernst postülasıyla ortadan kaldırılır. S(Т=0)=0 koyabiliriz. Т=0'daki tüm denge süreçleri entropi değişimi olmadan gerçekleşir. Özellikle, Т=0'da S hacme bağlı değildir 21 Entropinin istatistiksel yorumu Bir durumun olasılığı, istatistiksel ağırlığı Ω ile orantılıdır, i. belirli bir makrodurumun gerçekleştirilebileceği mikroskobik yolların sayısı. sistemi, stat ile eyaletlerde bulunan iki alt sisteme ayırır. ağırlıklar Ω1 ve Ω2 Sistemin belirli bir durumunun gerçekleştirilebileceği yol sayısı: Ω=Ω1Ω2 22 Entropinin istatistiksel yorumu Т.о. logaritma istatistiği ağırlık, sistemin durumunun toplamsal bir fonksiyonudur: lnΩ=lnΩ1+lnΩ2 Sistem entropisi: S=klnΩ () burada k, Boltzmann sabitidir. Formül (), Boltzmann formülü olarak adlandırılır. 23 Entropinin istatistiksel yorumu. denge durumu, en yüksek statüye sahip durumdur. ağırlık (ve en büyük entropi), o zaman tersinmez süreçler meydana geldiğinde, izole edilmiş bir sistemin entropisinin arttığı sonucuna varabiliriz Dengedeki bir sistemin entropisi maksimum dalgalanmalardır Termodinamiğin ikinci yasası, bazen artan entropi yasası olarak adlandırılır izole bir sistemin entropisinin yalnızca artabileceği veya değişmeden kalabileceği: S≥0 25 26
§6 Entropi Genellikle, bir sistemin bir durumdan diğerine geçtiği herhangi bir süreç öyle bir şekilde ilerler ki, bu işlemin ters yönde yürütülmesi mümkün değildir, böylece sistem, çevreleyen cisimlerde herhangi bir değişiklik olmaksızın aynı ara durumlardan geçer. Bunun nedeni, enerjinin bir kısmının, örneğin sürtünme, radyasyon vb. nedeniyle süreçte dağılmasıdır. Doğadaki hemen hemen tüm süreçler geri döndürülemez. Herhangi bir süreçte, bir miktar enerji kaybolur. Enerjinin dağılmasını karakterize etmek için entropi kavramı tanıtıldı. ( Entropinin değeri karakterize eder sistemin termal durumu ve vücudun bu durumunun uygulanma olasılığını belirler. Verilen durum ne kadar olasıysa, entropi o kadar büyük olur.) Tüm doğal süreçlere entropide bir artış eşlik eder. Entropi, yalnızca kapalı bir sistemde, yani bu sistemin dışındaki cisimlerle enerji alışverişinin olmadığı bir sistemde meydana gelen idealize edilmiş bir tersinir süreç durumunda sabit kalır. Entropi ve termodinamik anlamı: Entropi- bu, sistemin durumunun böyle bir fonksiyonudur, tersine çevrilebilir bir süreçteki sonsuz küçük değişim, bu süreçte verilen sonsuz küçük miktardaki ısının, verildiği sıcaklığa oranına eşittir. Son bir tersine çevrilebilir işlemde, entropideki değişiklik aşağıdaki formül kullanılarak hesaplanabilir:
burada integral, sistemin ilk durumu 1'den son durum 2'ye alınır. Entropi bir durum fonksiyonu olduğundan, integralin özelliğihesaplandığı konturun (yol) şeklinden bağımsızlığıdır, bu nedenle integral yalnızca sistemin ilk ve son durumları tarafından belirlenir.
(1)
Δ S> 0 (2) (1) ve (2) ifadeleri yalnızca kapalı sistemler için geçerlidir, ancak sistem dış ortamla ısı alışverişi yapıyorsa, o zamanSher şekilde davranabilir. (1) ve (2) ilişkileri Clausius eşitsizliği olarak temsil edilebilir ∆S ≥ 0 onlar. kapalı bir sistemin entropisi ya artabilir (tersinir olmayan süreçlerde) ya da sabit kalabilir (tersinir süreçlerde). Sistem, 1. durumdan 2. duruma bir denge geçişi yaparsa, entropi değişir.
nerede dU Ve δAbelirli bir işlem için yazılmıştır. Bu formüle göre, ΔSbir katkı sabitine kadar belirlenir. fiziksel anlam entropinin kendisine değil, entropilerin farkına sahiptir. İdeal bir gazın süreçlerindeki entropi değişimini bulalım.
onlar. entropi değişiklikleriS Δ S 1→2 İdeal bir gazın durum 1'den durum 2'ye geçişi sırasındaki miktarı, işlemin türüne bağlı değildir. Çünkü adyabatik bir süreç için δQ = 0, sonra ∆ S= 0 => S= sabit yani adyabatik tersinir bir süreç sabit entropide ilerler. Bu nedenle izentropik olarak adlandırılır. İzotermal bir süreçte (T= sabit ; T 1 = T 2 : )
Bir izokorik süreçte (V= sabit ; V 1 = V 2 ; )
Entropi, toplamsallık özelliğine sahiptir: sistemin entropisi, sisteme dahil olan cisimlerin entropilerinin toplamına eşittir.S = S 1 + S 2 + S 3 + ... Moleküllerin termal hareketi ile diğer hareket biçimleri arasındaki niteliksel fark, onun rastgeleliği, düzensizliğidir. Bu nedenle, termal hareketi karakterize etmek için moleküler düzensizlik derecesinin nicel bir ölçüsünü tanıtmak gerekir. Parametrelerin belirli ortalama değerlerine sahip herhangi bir cismin herhangi bir makroskopik durumunu düşünürsek, o zaman bu, moleküllerin hacmin farklı kısımlarındaki dağılımında ve içinde birbirinden farklı olan yakın mikro durumların sürekli değişiminden başka bir şeydir. Moleküller arasında dağıtılan enerji. Bu sürekli değişen mikro durumların sayısı, tüm sistemin makroskopik durumunun düzensizlik derecesini karakterize eder,wverilen bir mikrodurumun termodinamik olasılığı olarak adlandırılır. Termodinamik Olasılıkwsistem durumları, bir makroskopik sistemin belirli bir durumunun gerçekleştirilebileceği yolların sayısı veya belirli bir mikro durumu uygulayan mikro durumların sayısıdır (w≥ 1 ve matematiksel olasılık ≤ 1 ). Bir olayın beklenmedikliğinin bir ölçüsü olarak eksi işaretiyle alınan olasılığının logaritmasını almayı kabul ettik: durumun beklenmedikliği eşittir =- Boltzmann'a göre entropiSsistemler ve termodinamik olasılık şu şekilde ilişkilidir: nerede - Boltzmann sabiti ( Çünkü gerçek süreçler geri döndürülemez, o zaman kapalı bir sistemdeki tüm süreçlerin entropisinde bir artışa yol açtığı iddia edilebilir - artan entropi ilkesi. Entropinin istatistiksel yorumunda bu, kapalı bir sistemdeki süreçlerin, mikro durumların sayısını artırma yönünde, başka bir deyişle, durumun olasılığı maksimum olana kadar daha az olası durumlardan daha olası olanlara doğru ilerlediği anlamına gelir. §7 Termodinamiğin ikinci yasası Enerjinin korunumu ve enerjinin dönüşümü yasasını ifade eden termodinamiğin birinci yasası, t/d süreçlerinin akış yönünü belirlemeye izin vermez. Ek olarak, birbiriyle çelişmeyen bir dizi süreç hayal etmek mümkündür.ienerjinin depolandığı m / d'nin başlangıcı, ancak doğada gerçekleşmezler. İkinci başlangıç t/d'nin olası formülasyonları: 1) tersinmez süreçler sırasında kapalı bir sistemin entropisindeki artış yasası: kapalı bir sistemdeki herhangi bir tersinmez süreç, sistemin entropisi artacak şekilde gerçekleşir ΔS≥ 0 (geri döndürülemez süreç) 2) ΔS≥ 0 (S= 0 tersinir ve Δ içinS≥ 0 tersinmez süreç için) Kapalı bir sistemde meydana gelen süreçlerde entropi azalmaz. 2) Boltzmann formülünden S = , bu nedenle, entropideki bir artış, sistemin daha az olası bir durumdan daha olası bir duruma geçişi anlamına gelir. 3) Kelvin'e göre: Tek sonucu ısıtıcıdan alınan ısının buna eşdeğer işe dönüştürülmesi olan dairesel bir işlem mümkün değildir. 4) Clausius'a göre: Tek sonucu daha az ısıtılmış bir cisimden daha fazla ısıtılmış bir cisme ısı transferi olan dairesel bir işlem mümkün değildir. 0 K'da t/d sistemlerini tanımlamak için Nernst-Planck teoremi (t/d'nin üçüncü yasası) kullanılır: dengedeki tüm cisimlerin entropisi, sıcaklık 0 K'ye yaklaştıkça sıfıra eğilim gösterir. teoremden Nernst-Planck bunu takip ediyorC p= C v = 0 0'da İLE §8 Termal ve soğutma makineleri. Carnot çevrimi ve verimliliği Kelvin'e göre t / d'nin ikinci yasasının formülasyonundan, ikinci türden bir sürekli hareket makinesinin imkansız olduğu sonucu çıkar. (Bir sürekli hareket makinesi, bir ısı kaynağını soğutarak çalışan, periyodik olarak çalışan bir motordur.)
Bir ısı motorunun çalışma prensibi: sıcaklığa sahip bir termostattan T 1 - ısıtıcı, çevrim başına alınan ısı miktarıQ 1 , ve sıcaklık ile termostat T 2 (T 2 < T 1) - buzdolabı, çevrim başına aktarılan ısı miktarıQ 2 , iş yaparken FAKAT = Q 1 - Q 2
doğrudan döngüısı motorlarında kullanılır - dışarıdan alınan ısı nedeniyle iş yapan periyodik olarak çalışan motorlar. Ters çevrim, soğutma makinelerinde kullanılır - dış kuvvetlerin çalışması nedeniyle ısının daha yüksek sıcaklığa sahip bir gövdeye aktarıldığı periyodik olarak çalışan kurulumlar. Dairesel işlem sonucunda sistem orijinal durumuna geri döner ve bu nedenle iç enerjideki toplam değişim sıfırdır. O zamanlarІ döngüsel süreç için t/d'yi başlat Q= Δ sen+ A= A, Yani çevrim başına yapılan iş, dışarıdan alınan ısı miktarına eşittir, fakat Q= Q 1 - Q 2 Q 1 - miktar sistem tarafından alınan ısı, Q 2 - miktar sistem tarafından verilen ısı. Isıl verim dairesel bir işlem için sistem tarafından yapılan işin sisteme verilen ısı miktarına oranına eşittir:
η = 1 için koşulQ 2 = 0, yani ısı motorunun bir ısı kaynağı olmalıdırQ 1 , ancak bu t/d'nin ikinci yasasıyla çelişir. Bir ısı motorunda olanın tersi işlem, bir soğutma makinesinde kullanılır.
Q= Q 2 - Q 1 < 0, следовательно A< 0. İş yapmadan, daha az ısınan bir cisimden ısı alıp daha sıcak olana vermek mümkün değildir. Carnot, t/d'nin ikinci yasasına dayanarak bir teorem çıkardı. Carnot teoremi: aynı ısıtıcı sıcaklıklarına sahip periyodik olarak çalışan tüm ısı motorlarının ( T 1) ve buzdolapları ( T 2), en yüksek verimlilik. tersine çevrilebilir makineler var. KPD eşit için ters çevrilebilir makineler T 1 ve T 2 eşittir ve çalışma sıvısının doğasına bağlı değildir. Çalışan bir beden, dairesel bir işlem gerçekleştiren ve diğer bedenlerle enerji alışverişinde bulunan bir bedendir. Carnot çevrimi, 2 izoterm ve 2 adiyabattan oluşan en ekonomik tersinir çevrimdir.
2-3 - adyabat. genleşme, gaz işe yarıyorA 2-3 >0 dış gövdeler üzerinde. 3-4 izotermal sıkıştırma T 2 buzdolabı; ısı alınırQ 2
ve iş yapılır 4-1-adyabatik sıkıştırma, gaz üzerinde iş yapılır 4-1 <0 внешними телами. İzotermal bir süreçtesen= const , yani Q 1 = A 12
Adyabatik genişleme ileQ 2-3 = 0 ve gaz işi A 23 iç enerji ile yapılır 23 = - sen
ısı miktarıQ 2 , izotermal sıkıştırma sırasında gazın buzdolabına verdiği sıkıştırma işine eşittir FAKAT 3-4
Adyabatik sıkıştırma çalışması
Döngüsel bir süreçte yapılan iş A = A 12 + A 23 + A 34 + A 41 = Q 1 + A 23 - Q 2 - A 23 = Q 1 - Q 2 ve 1-2-3-4-1 eğrisinin alanına eşittir. Isıl verim karnot döngüsü
2-3 ve 3-4 süreçleri için adyabatik denklemden elde ederiz O zamanlar
onlar. yeterlik Carnot çevrimi sadece ısıtıcı ve soğutucunun sıcaklıkları ile belirlenir. Verimliliği artırmak için farkı artırmak lazım T 1 - T 2 . ******************************************************* ****************************************************** Termodinamiğin ikinci yasası. Bir ısı motorunun çalışma prensibi. Karnot döngüsü. ısı motoru verimliliği. Termodinamiğin ikinci yasası (BNT) Enerjinin korunumu ve dönüşümünün evrensel yasasını ifade eden termodinamiğin birinci yasası (PNT), süreçlerin yönünü belirlemeye izin vermez. BNT sadece termodinamik sistemler için geçerlidir. VNT'nin birkaç eşdeğer formülasyonu vardır: 1. Tek sonucu soğuk bir cisimden sıcak bir cisme ısı transferi olan bir süreç imkansızdır (Clausius'un formülasyonu). 2. Tek sonucu, bir cismin soğuması nedeniyle iş performansı olan bir süreç imkansızdır (Thomson'ın formülasyonu). 3. Yalıtılmış bir sistemin entropisi, içinde meydana gelen herhangi bir işlemle azalmaz, ᴛ.ᴇ. dS³0, eşittir işaretinin tersine çevrilebilir süreçleri ve büyük işaretinin geri döndürülemez süreçleri ifade ettiği durumlarda (Clausius formülasyonu) Boltzmann formülü (31) S=klnW, VNT'nin üçüncü formülasyonunun istatistiksel bir yorumunu vermemize izin verir: İzole edilmiş bir sistemin durumunun termodinamik olasılığı W, içinde meydana gelen tüm süreçler için azalamaz. İzole bir sistemi oluşturan çok sayıda parçacığın kaotik hareketinin gerekli düzenliliklerini ifade eder. karnot döngüsü Carnot çevrimi, izotermal genişleme ve daralmanın sırasıyla 1-2 ve 3-4 eğrileri ile ve adyabatik genişleme ve daralmanın eğriler 2-3 ve 4-1 ile verildiği yerde gösterilmektedir. Bir ısı motorunun çalışma prensibi. Bir ısı motorunu, yakıtın yanması sırasında açığa çıkan ısıyı işe dönüştüren döngüsel bir cihaz olarak adlandırmak gelenekseldir. Isı motoru elemanları: Isıtıcı çalışan madde Buzdolabı Bir araba silindiri örneğinde hava ısıtılır, hava sıcaklığı yükselir, bu da pistonun ileri hareket etmesine neden olur. Hareketli piston krank milini döndürür ve daha sonra dişli sistemi aracılığıyla dönme hareketi tekerleklere iletilir. Verimlilik - Bu, harcanan enerjiye makinenin işidir. Herhangi bir ısı motorunun kapalı bir çevrimde çalışması için, şartlı olarak iki gövde olarak hayal edilebilecek bir dış ortam gereklidir - ısıtıcı T maks, Ve buzdolabı bir sıcaklıkta olan kısa süre(kısa süre< Т mах ). Sistemimiz ile temas halinde ısıtıcı ve buzdolabı sıcaklıklarının değişmediği varsayılmaktadır. Isıtıcı ile temas ettiğinde sistem ısı alır, buzdolabı ile temas ettiğinde ısı verir. termodinamikte var Carnot teoremi(Şekil 5.2): Pirinç. 5.2. Léonard Sadi Carnot (Fransız fizikçi ve askeri mühendis)
Mümkün olan maksimum verimliliğin gerçekleştirilmesi, sözde karnot döngüsü, ideal bir gaz, iki adiyabat ve iki izotermden oluşan kapalı bir çevrimden geçtiğinde (Şekil 5.3).
Pirinç. 5.3.Carnot çevrimi (saat yönünde hareket ettirilir)- iki izotermin kombinasyonu 1- 2, 3 - 4 ve iki adyabat 2- 3 ve 4- 1 ; ortam ile ısı alışverişi yapılır üzerinde izotermal araziler döngü: bölüm 1'de- 2 gaz ısı alırQ 1 ve 3. bölümde- 4 ısı verirQ 2 Gösterilen kapalı işlemin gerçekten formül (5.5)'e karşılık gelen bir etkinliğe sahip olduğundan emin olalım. Sistemin sıcaklığı T1 noktalarda 1, 2 Ve T2 noktalarda 3, 4 . Diğer termodinamik parametrelerin değerleri (p, v) bir indeks olarak diyagramda karşılık gelen noktanın numarasına sahip olacaktır. Alınan miktarı hesaplamamız gerekiyor Q1, ve verilen Q2ısı, gazın yaptığı işi bulun AC \u003d Q 1 - Q 2 ve döngü verimliliğini belirleyin. alanlarda olduğunu hemen fark ederiz. 2-3 Ve 4-1 sistem çevre ile ısı alışverişi yapmaz. Bu nedenle, sıcaklık Q1 sitede gaz alınır 1-2, ama sıcaklık Q2 sitede verir 3-4. Döngünün çeşitli bölümlerine daha yakından bakalım. İzoterm 1 -2. Bu bölümde gaz ısıtıcı ile temas halindedir ve hacimden izotermal genleşme meydana gelir. 1 hacme kadar V2. Sıcaklık 1 değişmez, bu nedenle iç enerji değişmez ve alınan tüm ısı gazın yaptığı işe harcanır:
İzotermal bir işlem sırasında gaz çalışmasının değerini zaten hesapladık, bu nedenle formülü dikkate alarak (2.13)
adyabat 2 -3. Burada sistem ısıtıcıdan ayrılır ve dış ortamla ısı alışverişi yapmaz: Q23 = 0. Gaz genişlemeye devam ediyor, ancak zaten adyabatik olarak. Gazın iç enerjisi nedeniyle iş yapılır ve sıcaklığı değerine düşer. T2. Döngünün bu aşamasında, tarafından sağlanan bilgilere ihtiyacımız var. adyabatik denklem:
İzoterm 3 -4. Sistem buzdolabına bağlanır ve gaz sıkışmaya başlar. İç enerji değişmeden kalır, gaz üzerinde iş yapılır ( 34< 0 ) ve öne çıkanlar
buzdolabına aktarılır. (5.6) 'ya benzer şekilde varız
adyabat 4 -1. Sistemin dış ortamdan bağlantısı kesilir ve izotermal olarak küçülmeye devam eder, bu da sıcaklığında bir artışa neden olur. 1 . Sonunda sistem orijinal durumuna geri döner. çünkü noktalar 4 Ve 1 adiabat üzerinde uzanırsak, (5.7)'ye benzer hacimler ve sıcaklıklar arasında bir ilişki elde ederiz:
(5.7) ve (5.9) denklemlerinden hacim oranlarını buluyoruz
bunu nereden takip ediyor Bu nedenle, buzdolabına verilen ısı Q2(bkz. denklem (5.8)) şu şekilde yazılabilir:
Sistem tarafından alınan ısı için (5.6) ifadesini kullanarak çevrim sırasında yapılan işi buluruz.
Ayrıca analizden, çevrimdeki maksimum sıcaklığın şuna eşit olduğu sonucu çıkar. T maks \u003d T 1, ve minimum T min \u003d T 2.(5.12)'yi (5.6)'ya bölersek, buzdolabının ve ısıtıcının sıcaklıkları dışında tüm parametrelerin düştüğü Carnot döngüsünün verimliliği için hemen (5.5) ifadesini elde ederiz. örnek 1 Termik santralin kazanı yakl. t 1 \u003d 550 ° С. Atık ısı, yaklaşık bir sıcaklıkta nehre giderilir. t 2 \u003d 20 ° С. Bu istasyonun mümkün olan maksimum verimini bulalım (Şekil 5.4).
Pirinç. 5.4. Carnot ısı makinesinin şeması Carnot çevrimi verimliliği formülünde mutlak sıcaklıklar kullanıldığından, Celsius ölçeğinden Kelvin ölçeğine geçmeliyiz: T 1 \u003d 550 + 273 \u003d 823 K, T 2 \u003d 20 + 273 \u003d 293 K. Şimdi termik santralin verimliliğini buluyoruz:
Tabii ki, istasyonun gerçek verimliliği belirgin şekilde daha düşüktür. Carnot çevrimi ters yönde, yani Şekil 2'de saat yönünün tersine gerçekleştirilirse. 5.2, daha sonra formül (5.3), (5.4) ve (5.6), (5.11) ifadeleri soğutma tesisinin verimini belirlemek için kullanılmalıdır. o zaman alırız
Ne yazık ki, ortam sıcaklığı ne kadar düşükse 1 bir buzdolabına ne kadar az ihtiyaç duyarsak, o kadar verimli çalışır.
Pirinç. 5.5. Soğutma ünitesinin çalışma şeması Sayısal bir örnek verelim. Klima odadaki sıcaklığı koruyorsa t 2 \u003d 20 ° С ve dış hava sıcaklığı t 1 \u003d 30 ° С, o zaman sahip olduğumuz performans katsayısı için
ve buzdolabının verimliliği için
Tabii ki aslında yakıt elemanının sıcaklığı dış sıcaklıktan 20-30 derece daha yüksek olduğu için sıcaklık farkı 30-40 dereceye kadar çıkabiliyor, bu da değerlere yol açıyor.
Carnot döngüsüne göre çalışan ideal kurulumlardan bahsettiğimizi hatırlayın. Gerçek tipik klima güç tüketir 750W yaklaşık bir saat pompalama 5 MJ Termal enerji. Bu, klimanın bir saniyede çalıştığı anlamına gelir. A = 750 J ve odadaki havadan ısı alır
Buradan buluyoruz Gerçek bir klimanın ideal bir Carnot buzdolabından çok daha az verimli olduğunu görüyoruz. Örnek 2 Buzdolabınızı bir sıcaklıkta tutun t 2 \u003d -3 ° С (T2 \u003d 270 K) ve mutfaktaki sıcaklık t 1 \u003d 27 ° С (T 1 \u003d 300 K). Buzdolabı motorunun daha fazla güç tüketmesine izin verin N = 200 W. Buzdolabının Carnot çevrimine göre çalıştığını ve yakıt elemanının ortam sıcaklığına sahip olduğunu varsayarak, buzdolabı odasından mutfağa pompalanan ısı enerjisi akışının gücünü belirleriz. Sırasında T motor işi yapacak Buzdolabının verimliliği,
birim zaman başına mutfağa giren ısı miktarını bulduğumuz yer:
Lütfen buzdolabının çok verimli bir şekilde çalıştığını unutmayın. ısıtıcı bina. Sadece motor tarafından tüketilen güç için ödeme yapmanız gerekiyor 200W, ve mutfağa gidecek 10 kere büyük enerji, 90 % buzdolabı odasından pompalanan ( 90 % bu örnekte buzdolabının verimliliğidir). Bir buzdolabı yerine aynı güçte bir ısıtıcı açılırsa, odayı ısıtması ilginçtir. 10 kere daha zayıf. Sayısal tahminlerimiz, teknik bir uygarlığın özelliği olan çevrenin termal kirliliğine bir örnek olarak düşünülebilir. Ek Bilgiler http://eqworld.ipmnet.ru/ru/library/physics/thermodynamics.htm - J. de Boer Moleküler fizik ve termodinamiğe giriş, Ed. IL, 1962 - s. 202–205, bölüm 2, bölüm. 2, § 10: Claude-Heilandt gaz sıvılaştırma süreci açıklanmaktadır. |
| Okumak: |
|---|
Yeni
- Tarih üzerine metinler, Korkunç İvan'ın saltanatı
- Denikin: iç savaşın ana stratejisti İç savaştan sonra Denikin'e ne oldu
- “Anne ormanın içinden hamama gitti ...”
- "Kaptanlar", Gumilev Gumilev kaptanlarının şiir döngüsünün analizi okudu
- Gün batımında girin - sunum
- Alexander Blok ve Lyubov Mendeleeva: üçüncünün gereksiz olmadığı garip bir aile birliği Genç yayıncı ve oyun yazarı
- "Sibirya cevherlerinin derinliklerinde ..." A
- Dante ve Beatrice: İnsanın Bir Meleğe Aşkı Dante'nin Sevgilisine
- Evgeny Yevtushenko alıntılar
- Okul kafeteryasında yemek yemek özel bir konudur.Fotoğraf: Tamara Khamitsevich

 Bir termodinamik sistemin denge durumu, bu durumu karakterize eden makroskopik niceliklerin değerlerinin sabitliği ile belirlenir. Tersinir, A → B gibi bir termodinamik işlemdir ve bu işlem
Bir termodinamik sistemin denge durumu, bu durumu karakterize eden makroskopik niceliklerin değerlerinin sabitliği ile belirlenir. Tersinir, A → B gibi bir termodinamik işlemdir ve bu işlem  Carnot döngüsü Saddi Carnot 1796 -1832 Fransa. Vücut ısı verir → işaret “-” olarak değişir η- Aynı koşullar altında çalışan tüm tersinir sistemler aynıdır ve sadece ısıtıcı ve buzdolabının sıcaklıkları ile belirlenir. T 1 4 2 3 S
Carnot döngüsü Saddi Carnot 1796 -1832 Fransa. Vücut ısı verir → işaret “-” olarak değişir η- Aynı koşullar altında çalışan tüm tersinir sistemler aynıdır ve sadece ısıtıcı ve buzdolabının sıcaklıkları ile belirlenir. T 1 4 2 3 S Tersinir olmayan adyabatik bir süreçte, herhangi bir η-tersinmez makinenin entropi artışları her zaman aynı koşullar altında çalışan tersinir bir makinenin η'dan daha azdır. Termal makine. 1 2 4 3
Tersinir olmayan adyabatik bir süreçte, herhangi bir η-tersinmez makinenin entropi artışları her zaman aynı koşullar altında çalışan tersinir bir makinenin η'dan daha azdır. Termal makine. 1 2 4 3 Termodinamiğin 2. yasasının habercileri. Buzdolabı olmadan periyodik olarak çalışan bir ısı motoru yapmak mümkün müdür? . Q 2=0 => böyle bir makine, ısıtıcıdan aldığı tüm ısıyı işe çevirecektir. Burada enerjinin korunumu yasası ihlal edilmez. O zaman 2. tür bir sürekli hareket makinesi yaratmak mümkün olur (2. türden sürekli hareketli) => “Sınırsız” bir kaynaktan (okyanustan, atmosferden, Dünya'nın bağırsaklarından) ısı ödünç alır ve işe dönüştürürüz. . ... ısı ve sürekli hareket => Wilhelm Ostwald (1853 -1932)
Termodinamiğin 2. yasasının habercileri. Buzdolabı olmadan periyodik olarak çalışan bir ısı motoru yapmak mümkün müdür? . Q 2=0 => böyle bir makine, ısıtıcıdan aldığı tüm ısıyı işe çevirecektir. Burada enerjinin korunumu yasası ihlal edilmez. O zaman 2. tür bir sürekli hareket makinesi yaratmak mümkün olur (2. türden sürekli hareketli) => “Sınırsız” bir kaynaktan (okyanustan, atmosferden, Dünya'nın bağırsaklarından) ısı ödünç alır ve işe dönüştürürüz. . ... ısı ve sürekli hareket => Wilhelm Ostwald (1853 -1932) Isı makinelerinin iş yapma olasılığı, daha sıcak olan bir vücuttan daha az ısınan bir vücuda ısı transferinden kaynaklanmaktadır.
Isı makinelerinin iş yapma olasılığı, daha sıcak olan bir vücuttan daha az ısınan bir vücuda ısı transferinden kaynaklanmaktadır.



 Entropi ve için - azaltılmış ısı, Ancak oran, sistemin durumunun bir fonksiyonudur - entropi, burada S durum parametresidir (P, V, T'nin yanı sıra) Kapalı veya izole bir sistemde, herhangi bir tersinir sırasında süreç, entropi değişmeden kalır
Entropi ve için - azaltılmış ısı, Ancak oran, sistemin durumunun bir fonksiyonudur - entropi, burada S durum parametresidir (P, V, T'nin yanı sıra) Kapalı veya izole bir sistemde, herhangi bir tersinir sırasında süreç, entropi değişmeden kalır Kapalı bir termodinamik sistemde tersinmez bir süreç meydana geldiğinde, sistemin entropisi artar ve sistemin denge durumunda maksimum değerine ulaşır. Eğer öyleyse, sistemdeki herhangi bir değişiklik dış etki olmadan imkansızdır. - tersine çevrilebilir bir süreç için - geri döndürülemez bir süreç için Entropi, gerçek bir sürecin ideal olandan sapmasının bir ölçüsüdür.
Kapalı bir termodinamik sistemde tersinmez bir süreç meydana geldiğinde, sistemin entropisi artar ve sistemin denge durumunda maksimum değerine ulaşır. Eğer öyleyse, sistemdeki herhangi bir değişiklik dış etki olmadan imkansızdır. - tersine çevrilebilir bir süreç için - geri döndürülemez bir süreç için Entropi, gerçek bir sürecin ideal olandan sapmasının bir ölçüsüdür. I-başlangıç: II-başlangıç: Kapalı veya izole bir sistemde, geri dönüşü olmayan bir süreç meydana geldiğinde, sistemin entropisi artar ve sistemin denge durumunda maksimum değerine ulaşır. Sistem bir denge durumundaysa, sistemdeki herhangi bir değişiklik dış etki olmadan mümkün değildir. Kapalı bir sistemin entropisi yalnızca artabilir. 1. Doğada temel bir asimetrinin varlığını belirler - doğada kendiliğinden oluşan tüm süreçlerin tek yönlülüğü. 2. Kapalı sistemlerde enerji miktarı korunur, ancak enerji dağılımı geri döndürülemez şekilde değişir. III-başlangıç: Eğer T → 0 ise, o zaman S → 0, yani maddeyi mutlak sıfır sıcaklığına soğutmak mümkün değildir.
I-başlangıç: II-başlangıç: Kapalı veya izole bir sistemde, geri dönüşü olmayan bir süreç meydana geldiğinde, sistemin entropisi artar ve sistemin denge durumunda maksimum değerine ulaşır. Sistem bir denge durumundaysa, sistemdeki herhangi bir değişiklik dış etki olmadan mümkün değildir. Kapalı bir sistemin entropisi yalnızca artabilir. 1. Doğada temel bir asimetrinin varlığını belirler - doğada kendiliğinden oluşan tüm süreçlerin tek yönlülüğü. 2. Kapalı sistemlerde enerji miktarı korunur, ancak enerji dağılımı geri döndürülemez şekilde değişir. III-başlangıç: Eğer T → 0 ise, o zaman S → 0, yani maddeyi mutlak sıfır sıcaklığına soğutmak mümkün değildir.
 - AZ! Gerçek
- AZ! Gerçek 2. Clausius (1822 - 1888) 1850'de “Isı, daha az ısıtılmış bir cisimden daha sıcak bir cisme kendiliğinden aktarılamaz. “Genel olarak, “o” mümkündür. Ancak diğer tüm organlarda herhangi bir değişiklik olmaması şartıyla mümkün değildir. Buzdolabı, ancak süreç kendiliğinden değil, bir elektrik motorunun çalışması eşlik ediyor. 3. Nernst'in görüşü: Herhangi bir cismin entropisi sıfır olma eğilimindedir, çünkü T → 0 cisimlerin geri kalanı değişmedi.
2. Clausius (1822 - 1888) 1850'de “Isı, daha az ısıtılmış bir cisimden daha sıcak bir cisme kendiliğinden aktarılamaz. “Genel olarak, “o” mümkündür. Ancak diğer tüm organlarda herhangi bir değişiklik olmaması şartıyla mümkün değildir. Buzdolabı, ancak süreç kendiliğinden değil, bir elektrik motorunun çalışması eşlik ediyor. 3. Nernst'in görüşü: Herhangi bir cismin entropisi sıfır olma eğilimindedir, çünkü T → 0 cisimlerin geri kalanı değişmedi. Termodinamiğin ikinci yasası. Yalıtılmış bir sistemdeki termodinamik süreçlerin yönü → olasılığı maksimum olan durumlara: -Isı transferi => sıcaklık eşitlemesi. --Difüzyon => kabın bir yarısında homojen bir gaz toplanamaz. Entropi. İstatistiksel ağırlık - belirli bir makro durum w'nin uygulandığı farklı mikro durumların sayısı; Tüm makro-durumlar dengededir => bir makrodurumun olasılığı, istatistiksel ağırlığı ile orantılıdır. – entropi – bir termodinamik sistemin durumunun olasılığını karakterize eder.
Termodinamiğin ikinci yasası. Yalıtılmış bir sistemdeki termodinamik süreçlerin yönü → olasılığı maksimum olan durumlara: -Isı transferi => sıcaklık eşitlemesi. --Difüzyon => kabın bir yarısında homojen bir gaz toplanamaz. Entropi. İstatistiksel ağırlık - belirli bir makro durum w'nin uygulandığı farklı mikro durumların sayısı; Tüm makro-durumlar dengededir => bir makrodurumun olasılığı, istatistiksel ağırlığı ile orantılıdır. – entropi – bir termodinamik sistemin durumunun olasılığını karakterize eder. 2. tür bir sürekli hareket makinesinin imkansızlığı. Moleküllerin kendileri kabın ½ kısmında toplanır ve daha sonra sağlanan ısı nedeniyle izotermal olarak genişler, işi yaparlar: Moleküller kabın hacminin ½ kısmında gerçekten döngüsel olarak kendiliğinden toplanırsa her şey yolunda görünür. Ama bir ısı motoruyla entropi artar! ama çünkü, o zaman
2. tür bir sürekli hareket makinesinin imkansızlığı. Moleküllerin kendileri kabın ½ kısmında toplanır ve daha sonra sağlanan ısı nedeniyle izotermal olarak genişler, işi yaparlar: Moleküller kabın hacminin ½ kısmında gerçekten döngüsel olarak kendiliğinden toplanırsa her şey yolunda görünür. Ama bir ısı motoruyla entropi artar! ama çünkü, o zaman Entropi ve olasılık arasındaki ilişki. Doğadaki her süreç öyle bir şekilde ilerler ki, sistem olasılığı daha büyük olan bir duruma geçer. Sistem belirli bir entropiye sahip bir durumdaysa, ezici bir olasılıkla, daha yüksek bir entropiye sahip bir duruma geçmesi, yani entropideki en olası değişikliğin onun artması olması beklenmelidir. Ancak entropide azalma olan süreçler de mümkündür - ortalama büyümede ω dalgalanmaları.
Entropi ve olasılık arasındaki ilişki. Doğadaki her süreç öyle bir şekilde ilerler ki, sistem olasılığı daha büyük olan bir duruma geçer. Sistem belirli bir entropiye sahip bir durumdaysa, ezici bir olasılıkla, daha yüksek bir entropiye sahip bir duruma geçmesi, yani entropideki en olası değişikliğin onun artması olması beklenmelidir. Ancak entropide azalma olan süreçler de mümkündür - ortalama büyümede ω dalgalanmaları.