Раздели на сайта
Избор на редакторите:
- Ролята на съюзниците във Втората световна война
- Тайната проверка на "царските останки" породи съмнения у православните
- Наследници на короната на Руската империя
- Промени в демонстрационните варианти на изпита по обществени науки
- Материали за подготовка за изпита по руски език Трудна версия на изпита по руски език
- Видове и размер на стипендиите за студенти в Русия
- Промени в изпита по физика Fipi демо версия на физика
- Пролетна наборна служба в армията и дати
- От коя дата е лятното обаждане
- Руски език USE дати на руски
реклама
| Молекулярна физика и термодинамика. Молекулярна физика и термодинамика Молекулярна физика и температура в Молекулярна физика и термодинамика |
|
ПРЕДГОВОР Молекулярна физика и термодинамика на фундаментално ниво обща концепцияза енергията и нейните трансформации, свойства и характеристики на материята в различни условия. Разглеждането на въпроси от този вид поставя основата за развитието на общотехнически и специални дисциплини. В бъдещата практическа дейност на завършил висшето образование тези знания и умения трябва да помогнат при поставянето и решаването на инженерни проблеми, както и при овладяването на нови видове машини и оборудване. Според това, в учебно ръководствопоследователно се въвеждат основните понятия и величини, характеризиращи топлинните явления, както и връзката между тях. Разглеждат се характеристиките на класическата статистика, разпределението на Максуел-Болцман, транспортните явления, концепцията за квантовата електроника и плазмата и фазовите трансформации. На основата на първия и втория принцип се разглеждат основите на термодинамиката. Текстът е придружен с примери за решаване на задачи по съответните теми. Приложението съдържа физически константи, някои математически зависимости, както и въпроси и задачи за провеждане на колоквиуми или самостоятелна работастуденти. Тук липсва материал, свързан с квантовата статистика и физиката твърдо тялоналични в нашето публикувано по-рано ръководство (3). Ръководството използва стандартната система единици SI, въпреки че в примерите са дадени нестандартни единици (cal, atm, mm Hg и т.н.). ВЪВЕДЕНИЕ МОЛЕКУЛНА ФИЗИКА И ТЕРМОДИНАМИКА Молекулярна физика- дял от физиката, който изучава структурата и свойствата на материята въз основа на идеите, произтичащи от опита, че всяко тяло се състои от Голям бройчастици (атоми или молекули) в непрекъснато хаотично топлинно движение. В механиката движението на тялото е еднозначно определено начални условияи сили, действащи върху тялото. Познавайки тези стойности, можете да изчислите позицията на тялото по всяко време. Такива явления се описват от динамични закони. Молекулярната физика се занимава с явления, причинени от действието на огромен брой частици. Когато такъв огромен брой частици се движат, чиито координати и скорости непрекъснато се променят, е невъзможно да се изчисли движението на всеки от огромния брой атоми или молекули дори на компютър, следователно в този случай вероятностните или статистически се проявяват закономерности, изследвани с методите на статистическата физика. Това означава, че законите на молекулярната физика не могат да бъдат сведени до законите на механиката. В статистическата физика се разглежда конкретен молекулен модел и към него се прилагат математическите методи на статистиката и теорията на вероятностите. Затова за изследването се използва статистически метод. Статистически методвъз основа на законите на теорията на вероятностите и математическата статистика. Статистическата физика разглежда равновесно състояние -състояние, при което макроскопичните параметри не се променят с времето. Изучават се методи на статистическата физика, например дифузия, топлопроводимост, топлинен капацитет - явления, които напълно се определят от структурата на материята. Макроскопичните процеси в тела, състоящи се от голям брой частици, също се изучават от термодинамиката. Термодинамика- дял от физиката, който изучава връзката и взаимопреобразуванията различни видовеенергия, топлина и работа. Термодинамиката не разглежда специфични молекулярни модели. Въз основа на експериментални данни се формулират основните закони или принципи на термодинамиката. Тези закони и техните последствия се прилагат за специфични физически явления, свързани с макроскопични енергийни трансформации, т.е. не с процеси, протичащи с отделни атоми и молекули, а с тела, състоящи се от много голям брой частици. По този начин предметът на термодинамиката и статистическата физика е един и същ, различават се само методите, които се допълват взаимно. Термодинамиката счита термодинамични системи. система наречен набор от физически обекти, затворени в краен регион на пространството. термодинамична системанаречен набор от макроскопични тела и полета, които обменят енергия и материя помежду си и с външната среда. Системата може да се състои и от едно тяло. Знаци, които характеризират системата, например налягане, температура, плътност и редица други, се наричат термодинамични параметри или параметри на състоянието.Обикновено се избира минималният брой параметри, които напълно описват състоянието на системата. Разграничете обширенпараметри, чиито стойности в зависимост от количеството на веществото и интензивенпараметри, чиито стойности не зависят от количеството на веществото. Пример за екстензивно количество е енергията, интензивно количество е плътността, температурата. Обикновено екстензивните параметри се обозначават с главни букви, а интензивните с малки букви. Съвкупността от всички термодинамични параметри определя термодинамичното състояние на системата. Уравнение на състоянието свързва минималния брой термодинамични параметри, необходими за описание както на състоянието на самата система, така и на други параметри. Термодинамичният метод се основава на определяне на състоянието на термодинамична система. Статистически и термодинамични методи са ефективни методиизследвания на всякакви системи, състоящи се от голям брой частици, а не само на молекулярни системи. Това означава, че тези методи са общи физични методи за изследване, а молекулярната физика е само една от областите на тяхното приложение. Молекулярна физика. Термодинамика. 1. Статистически и термодинамични методи 2. Молекулярно-кинетична теория на идеалните газове 2.1 Основни определения 2.2.Експериментални закони на идеалния газ 2.3 Уравнение на състоянието на идеален газ (уравнение на Клапейрон-Менделеев 2.4.Основно уравнение на молекулярно-кинетичната теория на идеален газ 2.5 Разпределение на Максуел 2.6 Разпределение на Болцман 3. Термодинамика 3.1 Вътрешна енергия. Законът за равномерното разпределение на енергията по степени на свобода 3.2 Първият закон на термодинамиката 3.3 Работа на газа при промяна на неговия обем 3.4 Топлинна мощност 3.5 Първи закон на термодинамиката и изопроцеси 3.5.1 Изохоричен процес (V = const) 3.5.2 Изобарен процес (p = const) 3.5.3 Изотермичен процес (T = const) 3.5.4. Адиабатен процес (dQ = 0) 3.5.5. Политропни процеси 3.6.Кръгов процес (цикъл). Обратими и необратими процеси. Цикъл на Карно. 3.7.Втори закон на термодинамиката 3.8 Реални газове 3.8.1 Сили на междумолекулно взаимодействие 3.8.2 Уравнение на Ван дер Ваалс 3.8.3 Вътрешна енергия на реален газ 3.8.4 Ефект на Джаул-Томсън. Втечняване на газове. 1. Статистически и термодинамични методиМолекулярна физика и термодинамика - клонове на физиката, които изучаватмакроскопични процеси свързани с огромния брой атоми и молекули, съдържащи се в телата. За изследване на тези процеси се използват два фундаментално различни (но взаимно допълващи се) метода: статистически (молекулярно-кинетичен) итермодинамика. Молекулярна физика - клон на физиката, който изучава структурата и свойствата на материята въз основа на молекулярно-кинетични концепции, основани на факта, че всички тела се състоят от молекули в непрекъснато хаотично движение. Процесите, изучавани от молекулярната физика, са резултат от комбинираното действие на огромен брой молекули. С помощта на се изучават законите на поведение на огромен брой молекулистатистически метод , което се основава на какви свойствамакроскопична система се определят от свойствата на частиците на системата, характеристиките на тяхното движение и осреднените стойности на динамичните характеристики на тези частици (скорост, енергия и др.).Например, температурата на едно тяло се определя от средната скорост на хаотичното движение на неговите молекули и не може да се говори за температура на една молекула. Термодинамика - клон на физиката, който изучава общите свойства на макроскопичните системи вспособен термодинамично равновесие и преходни процеси между тези състояния.Термодинамиката не разглежда микропроцеси , които лежат в основата на тези трансформации, но се базира на два принципа на термодинамиката - основни закони, установени експериментално. Статистическите методи на физиката не могат да се използват в много области на физиката и химията, докато термодинамичните методи са универсални. въпреки това статистически методипозволяват да се установи микроскопичната структура на дадено вещество, докато термодинамичните методи установяват само връзки между макроскопичните свойства. Молекулярно-кинетичната теория и термодинамиката се допълват взаимно, образувайки едно цяло, но се различават в методите на изследване. 2. Молекулярно-кинетична теория на идеалните газове2.1 Основни определенияОбект на изследване в молекулярно-кинетичната теория е газ. Смята се, че газовите молекули, извършвайки произволни движения, не са свързани със сили на взаимодействие и затова се движат свободно, като се стремят в резултат на сблъсъци да се разпръснат във всички посоки, запълвайки целия предоставен им обем.Така газът заема обема на съда, който газът заема. Идеален газ е газ, за който: собственият обем на неговите молекули е незначителен в сравнение с обема на съда; между газовите молекули няма сили на взаимодействие; сблъсъците на газовите молекули една с друга и със стените на съда са абсолютно еластични.За много реални газове моделът на идеалния газ описва добре техните макросвойства. Термодинамична система - набор от макроскопични тела, които взаимодействат и обменят енергия както помежду си, така и с други тела (външната среда). Състояние на системата- набор от физически величини (термодинамични параметри, параметри на състоянието) , които характеризират свойствата на термодинамичната система:температура, налягане, специфичен обем. температура- физическа величина, характеризираща състоянието на термодинамично равновесие на макроскопична система.В системата SI използването е разрешено термодинамика и практична температурна скала .В термодинамичната скала тройната точка на водата (температурата, при която лед, вода и пара при налягане от 609 Pa са в термодинамично равновесие) се счита за равна наТ = 273.16 градуси Келвин[K]. В практически мащаб точките на замръзване и кипене на водата при налягане от 101300 Pa се считат за равни, съответно, t = 0 и t = 100 градуса по Целзий [° С].Тези температури са свързани с отношението Температурата T = 0 K се нарича нула Келвин, според съвременните концепции тази температура е недостижима, въпреки че е възможно да се приближите до нея колкото искате. налягане - физическо количество, определено от нормалната силаЕ действащ от страната на газа (течността) върху една област, поставена вътре в газа (течността) p = F/S, където S е размерът на площта. Единицата за налягане е паскал [Pa]: 1 Pa е равно на налягането, създадено от сила от 1 N, равномерно разпределена върху нормална към нея повърхност с площ от 1 m 2 (1 Pa = 1 N / m 2). Специфичен обеме обемът на единица маса v = V/m = 1/r, където V е обемът на масата m, r е плътността на еднородно тяло. Тъй като v ~ V за хомогенно тяло, макроскопичните свойства на едно хомогенно тяло могат да се характеризират както с v, така и с V. Термодинамичен процес - всяка промяна в термодинамична система, която води до промяна на поне един от нейните термодинамични параметри.Термодинамично равновесие- такова състояние на макроскопична система, когато нейните термодинамични параметри не се променят във времето.Равновесни процеси - процеси, които протичат по такъв начин, че промяната на термодинамичните параметри за краен период от време е безкрайно малка. изопроцеси са равновесни процеси, при които един от основните параметри на състоянието остава постоянен.изобарен процес - процес, протичащ при постоянно налягане (в координати V,t той е изобразенизобара ). Изохоричен процес- процес, протичащ при постоянен обем (в координати p,t той е изобразенизохора ). Изотермичен процес - процес, протичащ при постоянна температура (в координати p,V той е изобразенизотерма ). адиабатен процесе процес, при който няма топлообмен между системата и околната среда (в координати p,V той е изобразенадиабатен ). Константа (число) Авогадро - броят на молекулите в един мол N A \u003d 6,022. 10 23 . Нормални условия: p = 101300 Pa, T = 273,16 K. Тема 8. Феноменологична термодинамика Термодинамикаизучава количествените модели на преобразуване на енергията, дължащо се на топлинното движение на молекулите. Термодинамиката се основава на два основни закона, които са обобщение на многовековния опит от човешката дейност и се наричат принципи на термодинамиката. Първият закон описва количествените и качествените аспекти на процесите на преобразуване на енергията; вторият закон ни позволява да съдим за посоката на тези процеси. Термодинамична система- макроскопично тяло (или група от тела), което се характеризира с процеси, придружени от преход на топлина в други видове енергия. Пример за термодинамична система е газ, затворен в цилиндър под бутало. Състоянието на една термодинамична система се определя еднозначно от три параметъра: налягане, температура и обем, които се наричат параметри на състоянието. равновесно състояниетермодинамичната система (или състоянието на термодинамично равновесие) е състояние, при което параметрите на състоянието остават непроменени за произволно дълго време при непроменени външни условия. Равновесното състояние на графиката на състоянието е описано с точка. Случва се обаче състоянието на системата да не може да се определи от нито една стойност на параметъра, например: неравномерно нагрято тяло не може да се определи от една температурна стойност. Състоянията на системата, които не могат да бъдат характеризирани с една определена стойност на параметъра, са неравновесни. Неравновесно състояние- състояние, при което термодинамичните параметри в различни точки са различни. Стационарно състояниетермодинамична система - състояние, при което параметрите на състоянието на системата остават постоянни във времето и във всички части на системата. Термодинамичен процес– промяна на състоянието на системата. Графично представяне на равновесен процес се нарича диаграма на състоянието. равновесен процесе процес, състоящ се от непрекъсната последователност от равновесни състояния. Само безкрайно бавен обратим процес може да бъде в равновесие. Процеси, които не отговарят на тези изисквания - неравновесен. Графично могат да се изобразят само равновесни процеси - процеси, състоящи се от последователност от равновесни състояния. Всички реални процеси са неравновесни (те протичат с ограничена скорост), но в някои случаи неравновесието на реалните процеси може да бъде пренебрегнато (колкото по-бавно протича процесът, толкова по-близо е до равновесието). По-нататък разглежданите процеси ще се считат за равновесни. вътрешна енергияТермодинамична система се нарича съвкупността от всички видове енергия, които притежава, минус енергията на нейното транслационно движение като цяло и потенциалната енергия на системата във външно поле. Под вътрешната енергия Uв термодинамиката ще разберем енергията на топлинното движение на частиците, които образуват системата, и потенциалната енергия на тяхното взаимно положение. За идеален газ потенциална енергиявзаимодействието на молекулите се счита за нула. Следователно вътрешната енергия на един мол идеален газ е: От формула (1) виждаме, че вътрешната енергия на идеален газ е пропорционална на абсолютната температура. Вътрешната енергия има следните свойства: – в състояние на топлинно равновесие частиците на системата се движат така, че общата им енергия винаги е равна на вътрешната енергия; – вътрешната енергия е адитивна величина, т.е. вътрешната енергия на система от тела е равна на сумата от вътрешните енергии на телата, образуващи системата; – вътрешната енергия на системата е еднозначна функция на нейното състояние, т.е. всяко състояние на системата има само една стойност на енергията; това означава, че промяната на вътрешната енергия по време на прехода от едно състояние в друго не зависи от пътя на прехода. Величина, чието изменение не зависи от пътя на прехода, се нарича в термодинамиката държавна функция: DU=U 2 -U 1 не зависи от вида на процеса. Или Промяна във вътрешната енергия на системата може да възникне, ако: - системата получава отвън или отдава на околните тела някаква енергия под някаква форма; Системата работи срещу външни сили, действащи върху нея. Първи закон на термодинамикатаизразява закона за запазване на енергията за тези макроскопични явления, при които един от съществените параметри, определящи състоянието на телата, е температурата. Топлината, предадена на системата в процеса на промяна на нейното състояние, се изразходва за промяна на нейната вътрешна енергия и за извършване на работа срещу външни сили. Q=DU +НО(1) Често се налага разглежданият процес да се раздели на редица елементарни процеси, всеки от които съответства на много малка промяна в параметрите на системата. Нека напишем уравнение (1) за елементарния процес в диференциална форма: dQ=dU+dA, (2) където dU- малка промяна във вътрешната енергия; д Q - елементарно количество топлина; дА е основна работа. Уравнения (1) и (2) показват, че ако процесът е кръгов, т.е. в резултат на това системата се връща в първоначалното си състояние, след което DU= 0 и следователно Q=A.В кръгов процес цялата топлина, получена от системата, отива за производството на външна работа.
На графиката (p, V) работата е равна на площта на фигурата, ограничена от две ординати и функцията p (V) (фиг. 39.2). Да предположим, че системата преминава от едно състояние в друго, извършвайки работа по разширяване, но по два различни начина I и II: p 1 (V) и p 2 (V): A I е числено равна на площта на фигурата, ограничена от крива I, A II е площта на фигурата, ограничена от крива II: A I № A II. Като се има предвид израз (4), уравнението на първия закон на термодинамиката може да бъде написано, както следва: dQ=dU+pdV. Топлинният капацитет на система от тела (тяло)наречено физическо количество, равно на съотношението на количеството топлина dQ, които трябва да бъдат изразходвани за загряване на системата от тела (тяло), до промяна на температурата dT,характеризиращи това отопление: Специфична топлинавещества снаречена скаларна величина, равна на съотношението на топлинния капацитет на хомогенно тяло ОТспрямо теглото си: [° С]= J/(kg.K) моларен топлинен капацитетнаречена физическа величина, числено равна на съотношението на топлинния капацитет на системата ОТкъм количеството вещество n, съдържащо се в него: Има моларни топлинни мощности при постоянен обем и постоянно налягане: Уравнението, свързващо топлинните мощности при постоянно налягане и постоянен обем, има формата (уравнение на Майер): C p – C V = R. Като вземем предвид разпределението на енергията по степени на свобода и уравнението на Майер, получаваме разпределението на топлинните мощности C p и C V по степени на свобода: Когато се разглеждат термодинамичните процеси, е удобно да се използва връзката: Стойността на g се определя от броя и характера на степените на свобода на молекулата. За равновесните изопроцеси в газовете уравнението на първия закон на термодинамиката има формата: Първият закон на термодинамиката в изохоричен процес (V=const): Тук DT=T 2 –T 1 е температурната разлика между крайното и началното състояние. В този случай работата не е свършена:
Графиката на изобарния процес е показана на фиг. 41.1. Работата на изобарното разширение е равна на площта на фигурата, оцветена на фигурата и има стойността
Тук също можем да изведем уравнението на Майер и да формулираме физическия смисъл на универсалната газова константа. За изобарен процес (като се вземе предвид уравнението на Менделеев-Клапейрон) Ето защо Универсална газова константае числено равна на работата, която трябва да бъде извършена, за да се нагрее 1 мол вещество с 1 K при постоянно налягане.
И така, работете в изотермичен процес:
Изменението на вътрешната енергия dU=0, топлинният капацитет на системата е равен на безкрайност. Ако газът се разширява изотермично (V 2 >V 1), тогава към него се подава топлина и той извършва положителна работа, която се измерва с площта, защрихована на фигурата. Ако газът е изотермично компресиран (V 2 адиабатенПроцес, който протича без топлообмен с външната среда, се нарича: dQ=0, Q=0 За да бъде процесът адиабатен, е необходимо системата да бъде отделена от околните тела чрез топлонепроницаема преграда или процесът трябва да бъде много бърз и толкова бърз, че топлообменът да няма време да се установи. И така, за адиабатен процес уравнението на състоянието е: От уравнението на Менделеев-Клапейрон: T=pV/R. От уравнението на Менделеев-Клапейрон: V=RT/p. Уравнения (1), (2) и (3) са уравненията на адиабатния процес и се наричат уравнения на Поасон. Обяснение на този факт от молекулярно-кинетична гледна точка: налягането на газа се дължи на удара на молекулите върху стените на съда. При изотермичен процес броят на молекулярните удари за единица време на единица площ се променя, но средната сила на ударите не се променя. При адиабатен процес се променя както средният брой удари за единица време, така и средната сила на ударите. Първият закон на термодинамиката не дава никакви указания за посоката, в която могат да протичат процесите в природата. От гледна точка на първото начало в природата може да се осъществи всеки възможен процес, който не противоречи на закона за запазване и преобразуване на енергията. Например, ако има две тела, чиито температури са различни, то според първия закон на термодинамиката преносът на топлина от тяло с по-ниска температура към тяло с по-висока температура няма да противоречи. Единственото ограничение, наложено от първия принцип на този процес, е изискването количеството топлина, отделено от едно тяло, да бъде равно на количеството топлина, получено от второто. Вторият закон на термодинамиката позволява да се прецени посоката на процесите, протичащи в действителност. Той, заедно с първия закон, също така позволява да се установят много точни количествени зависимости между различни макроскопични параметри на тела в състояние на термодинамично равновесие. Френският инженер и физик Сади Карно се смята за основател на втория закон на термодинамиката. Той изучава условията за превръщане на топлината в работа. За да стигнем до формулировката на втория закон на термодинамиката, нека разгледаме схематично работата на топлинния двигател. В процеса на работа той извършва многократен кръгов процес (цикъл). кръгов процесе съвкупност от термодинамични процеси, в резултат на които системата се връща в първоначалното си състояние. На диаграмите на състоянието кръговите процеси са представени със затворени линии. Промяната във вътрешната енергия е 0: Директен цикълнаречен кръгов процес, при който системата извършва положителна работа Нека Q 1 - количеството топлина, което системата получава по време на разширение (фиг. 43.1); Q 2 - системата се отказа по време на компресия; U 1 е вътрешната енергия на системата в първото състояние, U 2 е вътрешната енергия на системата във второто състояние. Когато се разширява, работното вещество получава топлина Q 1 от нагревателя и извършва положителна работа A 1 . Според първия закон на термодинамиката: Q 1 \u003d U 2 -U 1 + A 1. По време на компресията се извършва работа върху работното вещество НО 2 и в същото време дава на хладилника количеството топлина Q 2: Q 2 \u003d U 1 -U 2 - A 2 В резултат: Q 1 - Q 2 \u003d A 1 -A 2 Така топлинният двигател направи директен кръгов цикъл, в резултат на което нагревателят отдели топлина Q 1 , хладилникът получи топлина Q 2 . Топлината Q \u003d Q 1 - Q 2 отиде да извърши работа A \u003d A 1 -A 2. В топлинния двигател не цялата топлина Q 1, получена отвън, се използва за извършване на полезна работа. Следователно топлинният двигател се характеризира с коефициент на полезно действие. Коефициентът на полезно действие (h) е съотношението на работата А, извършена за цикъл, към получената топлина за цикъл: От формула (1) на предходния параграф се вижда, че ефективността топлинна машина е по-малко от единица. Най-добрият би бил автомобил с коефициент на полезно действие равен на единица. Такава машина може напълно да преобразува цялата топлина, получена от определено тяло, в работа, без да дава нищо на хладилника. Многобройни експерименти показаха невъзможността да се създаде такава машина. Това заключение е достигнато за първи път от Сади Карно през 1824 г. След като изучава условията на работа на топлинните двигатели, той доказва, че са необходими поне два източника на топлина с различни температури, за да се произведе работа от топлинен двигател. По-късно това е изследвано подробно от Р. Клаузиус (1850) и В. Келвин (1852), които формулират втори закон на термодинамиката.
Формулировка Клаузиус(1850): Топлината не може спонтанно да се прехвърли от по-слабо нагрято към по-горещо тяло без промяна в системата. Тоест не е възможен процес, чийто единствен краен резултат е преносът на енергия под формата на топлина от по-слабо нагрято тяло към по-горещо. От това определение не следва, че топлината не може да се пренесе от по-малко нагрято към по-горещо тяло. Топлината се прехвърля от по-малко нагрято към по-горещо тяло във всяка хладилна инсталация, но преносът на топлина не е крайният резултат тук, тъй като в процеса се извършва работа. Формулировка Томсън (Келвин) (1851): Невъзможно е да се преобразува цялата топлина, взета от тяло с еднаква температура, в работа, без да се правят други промени в състоянието на системата. Тоест невъзможен е процес, единственият краен резултат от който е превръщането на цялата топлина, получена от дадено тяло, в еквивалентна на него работа. Тук не следва, че топлината не може напълно да се превърне в работа. Например при изотермичен процес (dU=0) топлината напълно се превръща в работа, но този резултат не е единственият, краен, тъй като газът все още се разширява тук. Може да се види, че горните формулировки са еквивалентни. Вторият закон на термодинамиката беше окончателно формулиран, когато всички опити да се създаде двигател, който да преобразува цялата получена от него топлина в работа, без да причинява други промени в състоянието на системата, завършиха с неуспех - вечен двигател от втори вид. Това е двигател с ефективност. 100%. Следователно друга формулировка на втория закон на термодинамиката: perpetuum mobile от втори род е невъзможна, т.е. такъв периодично работещ двигател, който ще получава топлина от един резервоар и ще преобразува тази топлина изцяло в работа. Вторият закон на термодинамиката ни позволява да разделим всички термодинамични процеси на обратимии необратим. Ако в резултат на някакъв процес системата преминава от държавата НОв друго състояние B и ако е възможно да го върне поне по един начин в първоначалното му състояние НОи освен това, по такъв начин, че не настъпват промени във всички останали тела, тогава този процес се нарича обратим. Ако това не е възможно, тогава процесът се нарича необратим. Обратим процес би могъл да се осъществи, ако правата и обратната посоки на неговия поток са еднакво възможни и еквивалентни. обратимиПроцесите са процеси, които протичат с много ниска скорост, в идеалния случай безкрайно бавно. В реални условия процесите протичат с крайна скорост, поради което могат да се считат за обратими само с определена точност. Обратно, необратимостта е характерно свойствопроизтичащи от самата природа на топлинните процеси. Пример за необратими процеси са всички процеси, придружени от триене, процеси на топлообмен при крайна температурна разлика, процеси на разтваряне и дифузия. Всички тези процеси в една посока протичат спонтанно, "сами по себе си", и за завършването на всеки един от тези процеси в обратна посокапаралелно трябва да протича някакъв друг, компенсиращ процес. Следователно при земните условия събитията имат естествен ход, естествена посока. Втори закон на термодинамикатаопределя посоката на протичане на термодинамичните процеси и по този начин дава отговор на въпроса какви процеси в природата могат да протичат спонтанно. Той показва необратимостта на процеса на прехвърляне на една форма на енергия - работа в друга - топлина. Работата е форма на енергиен трансфер на подреденото движение на тялото като цяло; топлината е форма на енергиен трансфер на неподредено хаотично движение. Подреденото движение може спонтанно да се превърне в неподредено. Обратният преход е възможен само ако работата се извършва от външни сили. Анализирайки работата на топлинните двигатели, Карно стигна до извода, че най-печелившият процес е обратим кръгов процес, състоящ се от две изотерми и две адиабати, тъй като се характеризира с най-висока ефективност. Този цикъл се нарича цикъл на Карно. Цикъл на Карное директен кръгов процес, при който извършената от системата работа е максимална. Цикълът се състои от две изотермични (1®2 и 3®4) и две адиабатични разширения и свивания (2®3 и 4®1) (фиг.45.1). Машина, която изпълнява цикъл на Карно, се нарича идеална топлинна машина. Работа, извършена по време на изотермично разширение: При адиабатно разширение работата се извършва поради намаляването на вътрешната енергия на системата, т.к Q=0: Работата, извършена върху системата по време на изотермично компресиране: Работа при адиабатно компресиране: A 2 \u003d -DU \u003d C V (T 2 -T 1). Нека изчислим ефективността на идеална топлинна машина. Нека напишем уравненията на Поасон за два адиабатични процеса: Като вземем съотношението им, получаваме: Изразявайки във формула (3) чрез и намалявайки с , получаваме: От тук формулираме Първата теорема на Карно: ефективността на обратимия цикъл на Карно не зависи от естеството на работния флуид и е функция само на абсолютните температури на нагревателя и охладителя. Втора теорема на Карно: всеки топлинен двигател, работещ при дадени температури на нагревател и охладител, не може да бъде по-ефективен от машина, работеща на обратим цикъл на Карно при същите температури на нагревател и охладител: Топлинна ефективност на произволен обратим цикъл където T max и T min са екстремните стойности на температурата на нагревателя и хладилника, участващи в изпълнението на разглеждания цикъл. концепция ентропия впървият е въведен от R. Clausius през 1862 г. Функция на състоянието S, чийто диференциал е: Наречен ентропия.Тук dQе безкрайно малко количество топлина, придадено на системата в елементарен обратим процес, Tе абсолютната температура на системата. Интегрирайки израз (2), получаваме: където S 1 и S 2 са стойностите на ентропията в състояния 1 и 2, Д.С.е промяната в ентропията по време на обратим процес. Промяната в ентропията във всеки обратим процес, който прехвърля системата от състояние 1 в състояние 2, е равна на намаленото количество топлина, предадено на системата в този процес. Всяко състояние на тялото съответства на една специфична стойност на ентропията. Ето защо ентропията е еднозначна функция на състоянието. физически смисълняма самата ентропия, а само разликата на ентропиите. Клаузий получи следните важни предложения, които формулираме без доказателство: 1. Ентропията е добавкаколичество: ентропията на система от няколко тела е сумата от ентропиите на всички тела. 2. Ентропията се определя само с точност до произволна константа. 3. Ако в изолирана система протичат обратими процеси, тогава нейната ентропия остава непроменена: 4. Ентропията на изолирана система се увеличава по време на необратим процес. Ентропията на изолирана система не може да намалее в никакъв процес. Математически тези разпоредби могат да бъдат записани като неравенство, наречено Неравенство на Клаузиус: 5. Ентропията на система в равновесно състояние е максимална. В природата всички реални процеси са необратими. Следователно може да се твърди, че всички процеси в една крайна изолирана система водят до увеличаване на ентропията. Това е принципът на увеличаване на ентропията. Въз основа на горното можем да формулираме втория закон на термодинамиката, както следва: в изолирани системи са възможни само такива процеси, при които ентропията не намалява. Тя е постоянна, ако процесите са обратими, и нараства, ако процесите са необратими. Ако системата не е изолирана, тогава нейната ентропия може да се държи по произволен начин. Ако системата отделя топлина (DQ<0), то ее энтропия убывает. Если такая система совершает замкнутый цикл, то энтропия в конце цикла буде равна исходному значению, то есть ее изменение равно нулю. Однако на разных этапах энтропия может и убывать, и возрастать, но так, что сумма всех изменений энтропии равно нулю. Тема 9. Молекулярно-кинетична теория В молекулярно-кинетичната теория те използват идеализиран моделидеален газ,според които считат, че: 1) собственият обем на газовите молекули е незначителен в сравнение с обема на съда; 2) няма сили на взаимодействие между газовите молекули; 3) сблъсъците на газовите молекули една с друга и със стените на съда са абсолютно еластични. В газ молекулите са толкова отдалечени една от друга през повечето време, че силите на взаимодействие между тях са практически нулеви. Можем да приемем, че кинетичната енергия на газовите молекули е много по-голяма от потенциалната, така че последната може да бъде пренебрегната. В молекулярната физика и термодинамиката състоянието на газ се характеризира с набор от три макропараметъра p, В, Т, които се наричат параметри на състоянието. Температурата е едно от основните понятия, които играят важна роля не само в термодинамиката, но и във физиката като цяло. температура- физическа величина, характеризираща състоянието на термодинамично равновесие на макроскопична система. В съответствие с решението на XI Генерална конференция по мерки и теглилки (1960 г.) в момента могат да се използват само две температурни скали - термодинамична и международна практическа ,
градуирани съответно в келвини (K) и градуси по Целзий (°C). В международната практическа скала точките на замръзване и кипене на водата при налягане от 1,013 10 s Pa, съответно, са O и 100 ° C (фиксирани точки). наляганев системата SI се измерва в Pa (паскал): 1N / m 2 \u003d 1 Pa. Често използвайте несистемни единици за налягане: 1 mm Hg. артикул = 133.3 Pa; техническа атмосфера 1 при = 750 mm Hg. Изкуство. » 10 5 Pa; нормална (физическа) атмосфера: 1 atm = 760 mm Hg "1,013. 10 5 Pa. Основното уравнение на кинетичната теория на газовете е връзката, която свързва налягането (количество, измерено експериментално) със скоростта или кинетичната енергия на газовата молекула. Този израз се нарича основното уравнение на молекулярно-кинетичната теория на идеалните газове.Това уравнение просто установява връзката между налягането и скоростта, или по-скоро средната квадратична скорост. Нека се запознаем В това уравнение налягането е свързано със средната енергия на постъпателното движение на молекулите. Налягането на газа е числено равно на 2/3 от средната кинетична енергия на постъпателното движение на молекулите, съдържащи се в единица обем. Налягането на идеален газ е свързано с температурата по следната връзка: Налягането се определя само от концентрацията (при постоянна температура) и не зависи от вида на молекулите. Ако имаме смес от няколко газа, концентрацията на молекулите на които n 1 , n 2 , ..., n iи Наляганията се наричат парциални налягания. Например, p 1 - парциално налягане съответства на налягането, което първият газ в сместа би упражнил, ако заемаше целия обем. Според Закон на Далтонв случай на идеални газове По този начин налягането, упражнявано върху стените на съда от смес от газове, е равно на сумата от парциалните налягания на отделните компоненти на сместа. 2.1. Основни понятия на молекулярната физика и термодинамика Молекулярна физика- дял от физиката, който изучава физичните свойства и структурата на материята в различни агрегатни състояния въз основа на тяхната микроскопична (молекулна) структура. Молекулярно-кинетична теория за структурата на материята- клон на молекулярната физика, в който свойствата на телата се изучават въз основа на идеи за тяхната молекулна структура. статистическа физика- клон на молекулярната физика, в който се изучават свойствата и движенията не на отделни молекули (частици), а на колекции от частици, характеризиращи се със средни стойности. Термодинамика- наука, която изучава свойствата на физическите системи без оглед на тяхната микроскопична структура. Система- набор от разглеждани тела (по-специално: молекули, атоми, частици). Опции за състояние на системата: p-налягане, V-обем, T-температура. а) Интензивни параметри
- параметри (налягане, температура, концентрация и др.), които не зависят от масата на системата. температура
- физическа величина, характеризираща състоянието на термодинамично равновесие на макроскопична система. Свойството на температурата е да определя посоката на топлообмена. Температурата в молекулярната физика определя разпределението на частиците по енергийни нива и разпределението на частиците по скорости. Термодинамична температурна скала
- температурна скала, определената температура (абсолютна температура), в която винаги е положителна. б) Обширни параметри
- параметри (обем, вътрешна енергия, ентропия и др.), чиито стойности са пропорционални на масата на термодинамичната система или нейния обем. Вътрешна енергия на системата- общата кинетична енергия на хаотичното движение на молекулите, потенциалната енергия на тяхното взаимодействие и вътрешномолекулната енергия, т.е. енергия на системата, без да се отчита нейната кинетична енергия като цяло (по време на движение) и потенциалната енергия във външно поле. Промяна на вътрешната енергия по време на прехода на системата от състояние в състояниее равна на разликата между стойностите на вътрешната енергия в тези състояния и не зависи от пътя на прехода на системата от едно състояние в друго. Уравнение на състоянието на системата: F(p,V,T) = 0. (2.1) Неравновесно състояние на системата- такъв, при който се променя някой от неговите параметри на състоянието на системата. Равновесното състояние на системата- такъв, при който всички параметри на състоянието на системата имат определени стойности, които са постоянни при постоянни външни условия. Време за релаксацияе времето, необходимо на системата да достигне равновесие. Процес- преминаването на системата от едно състояние в друго състояние, свързано с промяна на поне един от нейните параметри на състоянието: а) обратим процес
- процес, при който е възможно да се извърши обратен преход на системата от крайно към начално състояние през същите междинни състояния, така че да не останат промени в околната среда около системата; б) необратим процес
- процес, при който е невъзможно системата да се върне в първоначалното й състояние или ако в края на процеса са настъпили промени в средата или в самата система; в) кръгов процес (цикъл)
- такава последователност от трансформации, в резултат на която системата, напуснала всяко първоначално състояние, се връща отново към него. Всеки кръгов процес се състои от процеси на разширяване и свиване. Процесът на разширяване е придружен от работата, извършена от системата, а процесът на свиване е придружен от работата, извършена върху системата от външни сили. Разликата между тези произведения е равна на работата на този цикъл. Динамични модели -закони, които се подчиняват на системи от уравнения (включително диференциални, интегрални и т.н.), които позволяват съществуването на уникално решение за всяко начално условие. Статистически модели- количествени модели, установени чрез статистическия метод, който разглежда само средните стойности на количествата, характеризиращи даден набор от молекули (разглежда се конкретен молекулен модел и към него се прилагат математически методи на статистика, базирани на теория на вероятностите). Термодинамична вероятност- броят на начините, по които може да се реализира дадено състояние на макроскопична физическа система (границата, към която клони относителната честота на възникване на дадено събитие за достатъчно голям, клонящ към безкрайност, брой повторения на експеримента при постоянни външни условия): w = n/N, (2.2) където N е броят на експериментите; n е броят пъти, в които дадено събитие е получено. флуктуации- случайни отклонения на физическите величини от средната им стойност. Молекула- най-малката част от веществото, която има своите основни химични свойства и се състои от атоми, свързани помежду си с химически връзки. атом- част от вещество с микроскопични размери (микрочастица), най-малката частица от химичен елемент, която има неговите свойства. Атомите в различни комбинации влизат в състава на молекулите на различни вещества. Относителна атомна маса- отношението на масата на даден атом към 1/12 от масата на въглероден изотоп с масово число 12 (12 C). Относително молекулно тегло- съотношението на масата на дадена молекула към 1/12 от масата на 12 С атома. къртица- количеството вещество, което съдържа броя на частиците (атоми, молекули и други частици), равен на броя на атомите в 0,012 kg от въглеродния изотоп С 12. Числото на Авогадро- броят на атомите или молекулите в мол от всяко вещество: N A \u003d 6,0210 23 mol -1. Моларна маса- масата на веществото, взето в количество от един мол: \u003d m 0 N A. (2.3) 2.2. Основни понятия и закони на молекулярно-кинетичната теория Идеален газ- теоретичен модел на газ, който не отчита взаимодействието на неговите частици (средната кинетична енергия на частиците е много по-голяма от енергията на тяхното взаимодействие). Размерите на молекулите на идеалния газ са малки в сравнение с разстоянията между тях. Общият присъщ обем на молекулите на такъв газ е малък в сравнение с обема на съда. Силите на взаимодействие между молекулите са толкова малки, че движението на молекулите от сблъсък на сблъсък става по права линия. Броят на молекулярните сблъсъци за секунда е голям. Основните положения на молекулярно-кинетичната теория на идеален газ: 1) газът се състои от най-малките частици - атоми или молекули, които са в непрекъснато движение; 2) във всеки, дори много малък обем, към който са приложими заключенията на молекулярно-кинетичната теория, броят на молекулите е много голям; 3) размерите на молекулите са малки в сравнение с разстоянията между тях; 4) газовите молекули се движат свободно между две последователни взаимодействия помежду си или със стените на съда, в който се намира. Силите на взаимодействие между молекулите, с изключение на моментите на сблъсък, са незначителни. Сблъсъци на молекули стават без загуба на механична енергия, т.е. според закона за абсолютно еластично взаимодействие; 5) при липса на външни сили газовите молекули се разпределят равномерно в целия обем; Основното уравнение на молекулярно-кинетичната теория на газовете: където Основното уравнение на молекулярно-кинетичната теория на газовете за налягане: където n 0 = N "/V е броят на молекулите на единица обем; k - константата на Болцман. Закон на Авогадро: същите обеми при същите температури и налягания съдържат същия брой молекули. Закон на Далтон:налягането на газовата смес е равно на сумата от парциалните налягания, т.е. онези налягания, които всеки от газовете, включени в сместа, би имал, ако беше сам в обема, зает от сместа: Уравнението на състоянието на идеални газове за произволна масам(уравнение на Менделев-Клапейрон): където R е газовата константа, която числено е равна на работата по разширяването на един мол газ, когато се нагрява с една степен при условия на постоянно налягане; Т е абсолютната температура. Степени на свобода i е броят на независимите координати, необходими за пълно описание на положението на системата в пространството. Всички степени на свобода са равни. Общ брой степени на свобода където i kp - броят на степените на свобода на точковите трептения по време на транслационно движение; i kvr - броят на степените на свобода на точковите трептения по време на въртеливо движение. Газовите молекули имат няколко степени на свобода: а) едноатомен
- i = 3 (три степени на свобода на постъпателно движение); б) двуатомни с еластична връзка между атомите
- i = 6; в) двуатомни с твърда връзка между атомите
- i = 5; г) триатомна молекула с твърда връзка между атомите
- i = 6. Теорема за равномерното разпределение на енергията по степени на свобода:за всяка степен на свобода има средно еднаква енергия, равна на където i \u003d i p + i vr + i k. Вътрешна енергия на произволна маса газмсе състои от енергията на отделните молекули: където е моларната маса на газа. Топлинен капацитет- физична величина, числено равна на количеството топлина, което трябва да се предаде на дадено вещество, за да се нагрее с един градус. Специфичен топлинен капацитет "° С"
- физическа величина, числено равна на количеството топлина, което трябва да се предаде на единица маса на вещество, за да се нагрее с един градус. Моларен топлинен капацитет "° С"
- физична величина, числено равна на количеството топлина, което трябва да се предаде на един мол вещество, за да се повиши неговата температура с един градус: Специфичен топлинен капацитет при постоянен обем"° С v "
- физична величина, числено равна на количеството топлина, което трябва да се предаде на единица маса от вещество, за да се нагрее с един градус при условия на постоянен обем: Специфичен топлинен капацитет при постоянно налягане "° С стр "
- физическо количество, числено равно на количеството топлина, което трябва да се предаде на единица маса от вещество, за да се нагрее с един градус при условия на постоянно налягане: Моларен топлинен капацитет при постоянен обем "° С v "
- физическо количество, числено равно на количеството топлина, което трябва да се предаде на един мол вещество, за да се повиши температурата му с един градус при условия на постоянен обем: Моларен топлинен капацитет при постоянно налягане "° С стр "
- физическо количество, числено равно на количеството топлина, което трябва да се предаде на един мол вещество, за да се повиши температурата му с един градус при условия на постоянно налягане: Съотношението на моларния и специфичния топлинен капацитет
:
Средноквадратична скорост на молекулите (за газ с маса "m", който е в равновесие, при T = const) остава постоянен: където N i е броят на молекулите със скорост v i ; N е броят на всички молекули. Най-вероятно скорост- скоростта на движение на молекулите, която характеризира позицията на максимума на функцията на разпределение на Максуел: Средна аритметична скорост Относителна скоростизползвани за изчисляване на броя на молекулите, движещи се със скорости между v и v + dv: u = v/v in. (2,20) Законът за разпределение на молекулите на идеалния газ по скорости в стационарно състояние (разпределение на Максуел): където dn v е средният брой молекули на единица обем със скорости в диапазона от v до v + dv; n е броят на молекулите на единица обем. Функция на разпределение (частта на молекулите от общия им брой е свързана с определен диапазон от скорости): където dn v /ndv е функцията на разпределение. Свободни пътища на молекулите- праволинейни участъци от траекторията, измината от молекулата между два последователни сблъсъка. Среден свободен път на молекулае средното разстояние, изминато от молекула между два сблъсъка: където Z е броят на сблъсъци; v - средна скорост на молекулата; k - константата на Болцман; d - диаметър на молекулата; p - налягане; Т е абсолютната температура. Среден брой сблъсъци- брой сблъсъци на молекули Ефективен молекулен диаметър d е минималното разстояние, на което центровете на 2 молекули се приближават един към друг по време на сблъсък. Ефективно напречно сечение- стойност, равна на = d 2 . (2,25) барометрична формулапоказва, че налягането намалява с височина толкова по-бързо, колкото по-тежък е газът и колкото по-ниска е неговата температура:
(2.26) Законът за разпределение на газовите молекули по височина в полето на гравитационните сили (разпределение на Болцман): където n o е броят на молекулите на единица обем в мястото, където потенциалната енергия на молекулите е равна на нула; n е броят на молекулите на единица обем в тези точки в пространството, където потенциалната енергия на молекулите е равна на W p . Разпределение на Максуел-Болцман -благодарение на това разпределение е възможно да се определи частта от молекулите на идеалния газ, имащи скорости в диапазона от v до v + dv и имащи потенциал = gh във външно силово поле: където v in - най-вероятната скорост, чиято стойност съответства на максимума на кривата на Максуел. Зависимост на плътността на газа от височината: където m o е масата на една молекула. 2.3. Основни положения и закони на термодинамиката Първи закон на термодинамиката- законът за запазване и трансформация на енергията, който придружава термодинамичните процеси - количеството топлина, подадено към системата, отива за промяна на нейната вътрешна енергия и работата, извършена от системата срещу външни сили: където dU е промяната във вътрешната енергия на системата; Q - елементарно количество топлина, подадено към системата; A е елементарната работа, извършена от системата. Изотермичен процес- процес протичащ при постоянна температура (T = const). При изотермичен процес цялата топлина, подадена към системата, се използва за извършване на работа от тази система. и U = const.
м
идеален газ в изотермичен процес:
изобарен процесе процес, протичащ при постоянно налягане (p = const). В този случай топлината, подадена към системата, отива както за промяна на нейната вътрешна енергия, така и за извършване на работа от тази система: Работа, извършена от произволна маса
м
Промяна на вътрешната енергия на произволна маса
м
идеален газ в изобарен процес:
Изохоричен процесе процес, протичащ при постоянен обем (V = const). В този случай цялата топлина, доставена на системата, отива за промяна на нейната вътрешна енергия: адиабатен процес- процес, който протича без топлообмен или почти без топлообмен с околната среда. В този случай работата може да се извърши от системата само поради намаляването на нейната вътрешна енергия: Уравнения на адиабатен процес (уравнения на Поасон):
Работа, извършена от произволна маса
м
идеален газ при адиабатно разширение:
Политропен процес- такъв процес, при който p и V са свързани чрез отношението: където n е политропният индекс, който приема произволна стойност от - до + . По-специално, за изобарен процес n = 0, изотермичен - n = 1, адиабатен - n = , изохоричен - n = . Работа, извършена от произволна маса
м
идеален газ в политропен процес:
Работата, извършена от идеален газ в кръгов процес, еравна на разликата в работата по време на разширение A 1 и по време на компресия A 2 на газа и е еквивалентна на разликата в количеството топлина, подадено към системата по време на разширение Q 1 и отстранено от нея по време на компресия Q 2 :
Ефективност на кръгов процес (цикъл) -физическо количество, равно на съотношението на работата на цикъла към работата, която може да бъде извършена чрез преобразуване на цялото количество топлина, доставена на системата в нея: Цикъл на Карно- цикъл, състоящ се от два изотермични и два адиабатни процеса. Работа, извършена от произволна маса
м
идеален газ в цикъла на Карно,
е разликата между работата, извършена от системата по време на разширяване, и работата, извършена върху системата по време на нейното свиване: Ефективност на цикъла на Карно
не зависи от естеството на веществото, а зависи само от температурите, при които топлината се подава към системата и се отнема от нея: Ефективност на хладилната машина (хладилник): Ото цикълсе състои от две адиабати и две изохори. Дизелов цикълсе състои от две адиабати, изохора и изобара. Ентропия- физическо количество, чиято елементарна промяна по време на прехода на системата от едно състояние в друго е равно на количеството получена или отдадена топлина, разделено на температурата, при която е настъпил този процес: Връзка на ентропията на системата с термодинамичната вероятност (отношение на Болцман): S = kln w, (2.47) където k е константата на Болцман.
преминаване от едно състояние в друго Промяната в ентропията на системата при
преминаване от едно състояние в друго: Промяната в ентропията на системата при
изотермичен процес: Промяната в ентропията на системата при
изобарен процес: Промяната в ентропията на системата при
изохорен процес: Промяната в ентропията на системата при
адиабатен процес: S = 0, Промяната в ентропията на система, която изпълнява цикъл на Карно: където S p е изменението на ентропията на работния флуид; S n, S x - изменение на ентропията на нагревателя и хладилника; S pr - изменение на ентропията на "консуматора на работа". Ако системата изпълнява обратим цикъл на Карноентропията на затворена система не се променя: S arr = 0 или S arr = const. (2,55) Ако системата изпълнява необратим цикъл на Карноентропията на затворена система се увеличава: S 0; За произволни процеси, протичащи в затворена система,ентропията на системата за всички процеси, протичащи в нея, не може да намалее: S 0 или където знакът за равенство е валиден за обратимите процеси, а знакът за неравенство за необратимите. Втори закон на термодинамиката:в изолирана система са възможни само такива процеси, при които ентропията на системата се увеличава или е невъзможен процес, единственият резултат от който е превръщането на получената от нагревателя топлина в работа: Термодинамични потенциали- определени функции на обем V, налягане p, температура T, ентропия S, брой частици на системата N и други макроскопични параметри x, характеризиращи състоянието на термодинамичната система: а) вътрешна енергия
- енергията на системата, в зависимост от нейното вътрешно състояние. Това е функция с една стойност на независими променливи, които определят това състояние, например температура T и обем V (или налягане p): U = U(S, V, N, x). (2,59) Промяна във вътрешната енергия на системата
U
се определя само от неговите стойности в началното и крайното състояние: б) енталпия (топлинно съдържание)
характеризира състоянието на макроскопична система в термодинамично равновесие, когато ентропията S и налягането p са избрани като основни независими променливи: H = H(S,p,N,x). (2,61) Системна енталпия
равна на сбора от енталпиите на съставните му части. Връзка между енталпия и вътрешна енергия
U
системи:
където V е обемът на системата. Диференциалът на общата енталпия (при постоянна
н
и
х
) има формата
Връзка на енталпията с температурата, обема и топлинния капацитет (при постоянно налягане) на системата:
Промяна на енталпията
(
з)
е равно на количеството топлина, което се съобщава на системата или се отстранява от нея при постоянно налягане, така че стойностите на H характеризират топлинните ефекти на фазовите преходи (топене, кипене и т.н.), химични реакции и други протичащи процеси при постоянно налягане. в) безплатна енергия- едно от имената на изохорно-изотермичния термодинамичен потенциал или енергията на Хелмхолц. Представлява тази част от вътрешната енергия на системата, която се преобразува във външна работа при обратими изотермични процеси F = F(V,T,N,x): където TS е свързаната енергия. Свързана енергия
представлява тази част от вътрешната енергия, която не може да бъде прехвърлена под формата на работа в изотермичен процес: TS = U - F. (2,66) Промяна (намаляване) на свободната енергия по време на необратими изотермични процеси
определя максималното количество работа, което системата може да извърши: г) енергия на Гибс- изобарно-изотермичен потенциал, свободна енталпия, характерна функция на термодинамична система за независими параметри p, T и N - G. При изотермично равновесен процес при постоянно налягане загубата на енергия на Гибс на системата е равна на общата работа на системата минус работата срещу външно налягане (т.е. равна на максималната стойност на "полезна" работа): G = G(p,T,N,x); Връзка между енергията на Гибс и свободната енергия:
д) химичен потенциал- физическа величина, равна на енергията на Гибс на отделна частица. Третият закон на термодинамиката (теорема на Нернст):промяната в ентропията на системата (S) при всякакви обратими изотермични процеси между две равновесни състояния при температури, близки до абсолютната нула, клони към нула. С помощта на последователност от термодинамични процеси е невъзможно да се достигне температура, равна на абсолютната нула: Термодинамика на неравновесните процеси- Обща теория на макроскопичното описание на неравновесни процеси. Основната задача на термодинамиката на неравновесните процеси е количественото изследване на тези процеси за състояния, които не се различават много от равновесното състояние. Закон за запазване на масата: където е плътността на многокомпонентна система; v- хидродинамична скорост на средата (средна скорост на масообмен), в зависимост от координатите и времето; ∙ v- масов поток. Законът за запазване на масата за концентрацията на всеки компонент където c k е концентрацията на компонента; k - плътност на компонента; - средна плътност; J k = k (v k - v) - дифузионен поток; v k е хидродинамичната скорост (средна скорост на пренос на маса) на компонента. Закон за запазване на импулса:може да възникне промяна в импулса на елементарен обем поради силите, причинени от градиента на вътрешните напрежения в средата P , и външни сили Ек. Закон за запазване на енергиятапредставлява първия закон на термодинамиката в термодинамиката на неравновесните процеси. Уравнение на ентропийния баланс:в термодинамиката на неравновесните процеси се приема, че ентропията на елементарен обем е същата функция на вътрешна енергия, специфичен обем и концентрация, както в състояние на пълно равновесие: където е скоростта на нарастване на ентропията; - плътност на веществото; s е ентропията на елементарен обем (локална ентропия); J s е плътността на ентропийния поток. 2.4. реални газове. Фазови равновесия и трансформации истински газ- газ, чиито свойства зависят от взаимодействието на частиците и собствения им обем, което е особено очевидно при високи налягания и ниски температури. Уравнение на състоянието на реалните газове (уравнение на Ван дер Ваалс) за произволна маса на газ: където "а" е корекцията на Ван дер Ваалс за ефекта на силите на междумолекулно взаимодействие (върху вътрешното налягане); "c" - ван дер Ваалсова корекция за собствения обем на молекулите; μ е молекулното тегло на газа; m е масата на газа. Вътрешна енергия на реален газсе състои от кинетичната енергия на постъпателното и въртеливото движение на молекулите Е k и потенциалната енергия на тяхното взаимодействие Е p . Потенциална енергия на взаимодействие на един мол реални газови молекули
е с отрицателен знак, т.к молекулярните сили, които създават вътрешното налягане p" са сили на привличане: Промяна в потенциалната енергия на реален газ (за мол)
е равна на работата, извършена от вътрешното налягане p, когато газът се разширява от обем V 1 до V 2: Кинетична енергия на реални газови молекули (за мол)
съгласно теоремата за равномерното разпределение на енергията по степени на свобода (в известно приближение): Вътрешна енергия на един мол реален газ:
Промяната в температурата на реален газ по време на адиабатно разширение (в този случай газът се охлажда) или компресия (в този случай газът се нагрява): Ефект на Джаул-Томсън- промяна в температурата на реалния газ при разширяване през пореста преграда. Ако газът се охлажда по време на разширение, тогава ефектът на Джаул-Томсън се нарича положителен, ако се нагрява - отрицателен. Фаза- равновесно (в термодинамиката) състояние на вещество, което се различава по физични свойства от други възможни равновесни състояния на същото вещество. Фазови трансформации- преходът на вещество от една фаза в друга, свързан с качествени промени в свойствата на веществото при промяна на външните условия. Фазов баланс- едновременно съществуване на термодинамично равновесни фази в многофазна система. Фазово правило на Гибс:в вещество, състоящо се от n компонента, не могат да съществуват едновременно повече от (n + 2) равновесни фази. Броят на физическите параметри на системата, които могат да бъдат променени, без да се нарушава фазовото равновесие: L = n + 2 - , (2.80) където е броят на фазите в равновесие. Уравнение на Клаузиус-Клапейронопределя промяната в температурата на фазовия преход с безкрайно малка промяна в налягането: където Q е топлината на фазов преход; Т е температурата на преход; dp/dT - производна на налягането спрямо температурата; dT/dp - производна на температурата спрямо налягането; (V 2 - V 1) - промяна в обема на веществото по време на прехода му от първата фаза към втората. Метастабилно състояние- състояние на нестабилно равновесие на физическа макроскопична система (фаза). Системата може да бъде в това състояние дълго време, без да премине в по-стабилно (при дадени условия) състояние (фаза). Линии (повърхнини) на фазово равновесие- графики, изобразяващи зависимостта на едни термодинамични променливи от други при условия на фазово равновесие. Диаграми на състоянието- набор от линии (повърхности) на фазово равновесие. Тройна точка -точката на пресичане на една линия (повърхност) на фазово равновесие с друга. Критична точка- точка от диаграмата на състоянието, съответстваща на критичното състояние на веществото. Състоянието на материята в критична точка се характеризира с критични стойности на температурата T k , налягането p k и обемът V k . Критична точка в случай на двуфазно равновесие
- крайна точка на линията (повърхността) на фазовото равновесие. преходна точка- стойността на температурата, налягането или някаква друга величина, при която възниква фазов преход. Фазов преход от първи родхарактеризиращ се с това, че по време на изпълнението му се абсорбира или отделя определено количество топлина, което се нарича топлина на фазов преход. Стойността на такива термодинамични величини на веществото като плътност, концентрация на компоненти се променя рязко. Фазов преход от втори род- такъв преход, при който някаква физическа величина, равна на нула от едната страна на точката на прехода, постепенно нараства с разстоянието от точката на прехода до другата страна, докато плътността на веществото се променя непрекъснато и няма абсорбция или освобождаване на топлина. 2.5. Кинетични явления (трансферни явления) Кинетични явления (трансферни явления)- необратими процеси, придружени от прехвърляне на всяка физическа величина, в резултат на прехода на всяка система от неравновесно състояние в равновесно състояние. Кинетични явления в молекулярната физика- вискозитет, топлопроводимост, дифузия. Вискозитет (вътрешно триене)- явлението на прехвърляне, в резултат на което импулсът (импулсът) на молекулите се прехвърля от един слой на газ или течност в друг. Силата на вътрешното триене в течност или газ се определя по формулата на Нютон:
където - коефициент на вискозитет; S - площ на контактни слоеве течност или газ; dv/dz - градиент на скоростта на флуид или газ в посока, перпендикулярна на посоката на потока; Коефициент на динамичен вискозитет
- физическа величина, числено равна на силата на вътрешно триене между два слоя течност или газ с единица площ при градиент на скорост, равен на единица: където n 0 е броят на молекулите на единица обем; u - средна скорост на топлинно движение на молекулите; m е масата на молекулата; - среден свободен пробег на молекулите; = n 0 ∙m - плътност на течност или газ. Коефициент на кинематичен вискозитет
- съотношението на динамичния вискозитет към плътността на веществото: ν = η/ρ. (2,84) дифузия- процесът на взаимно проникване на молекули (атоми) на чуждо вещество, дължащ се на тяхното топлинно движение. Дифузията винаги е придружена от пренос на маса. Характерно е за газове, течности и твърди вещества. самодифузия
- процесът на взаимно проникване на собствените му молекули (атоми), поради тяхното топлинно движение. Закон за дифузията (първи закон на Фик)
:
където D е коефициентът на дифузия; dс/dz е скоростта на изменение (градиент) на концентрацията по посока z; "минус" - показва, че масата се прехвърля в посока на намаляване на концентрацията на този компонент. Коефициент на дифузия
- физична величина, числено равна на масата на пренесеното вещество през единична площ за единица време с градиент на концентрация, равен на единица: където <>е средният свободен път на молекулите. Топлопроводимост
-
процесът на пренос на енергия между контактуващи тела или две повърхности на едно и също тяло, който възниква поради температурна разлика. Закон за топлопроводимост (закон на Фурие)
- количеството топлина dQ, пренесено през площта dS за времето dt: където æ е коефициентът на топлопроводимост; dT/dz е скоростта на промяна (градиент) на температурата в посока z. Коефициент на топлопроводимост
- физическа величина, която показва колко топлина се пренася през единица за единица време с температурен градиент, равен на единица: където c v е специфичният топлинен капацитет при постоянен обем. топлинен поток
- физическо количество, което показва колко топлина се предава за единица време през площта dS с температурен градиент dT / dz: Връзката между коефициентите на топлопроводимост, дифузия и вискозитет: |
Нов
- Как да съставя предложение?
- Руско-таджикски онлайн преводач и речник
- Ориентиране в града на английски език Ориентиране на английски език
- Руско-таджикски онлайн преводач и речник
- Места с най-добър климат за човешки живот в света
- Демо по география
- Изтеглете демо за социални изследвания
- Наръчник с основните факти на стереометрията
- Ege в англоговорящите речеви клишета
- Формули по физика, които е препоръчително да се научат и усвоят добре за успешното полагане на изпита

 , където U 2 и U 1 са стойностите на вътрешната енергия в състояния 1 и 2. Тук dU е общият диференциал.
, където U 2 и U 1 са стойностите на вътрешната енергия в състояния 1 и 2. Тук dU е общият диференциал. Ако U 1 \u003d U 2и Q \u003d A,тогава А = О.Означава, че не е възможен процес, чийто единствен резултат е производството на работа без никакви промени в други тела,тези. невъзможен перпетуум мобиле(вечен двигател) първи вид.
Ако U 1 \u003d U 2и Q \u003d A,тогава А = О.Означава, че не е възможен процес, чийто единствен резултат е производството на работа без никакви промени в други тела,тези. невъзможен перпетуум мобиле(вечен двигател) първи вид. Помислете за процеса на разширяване на газа. Нека газ е затворен в цилиндричен съд, затворен с подвижно бутало (фиг. 39.1). Да приемем, че газът се разширява. Той ще движи буталото и ще работи върху него. С малка денивелация dxгаз ще свърши работа dA= fdx,където Ее силата, с която газът действа върху буталото, R -налягане на газа вначалото на пътуването dx.Следователно, dQ = pSdx = pdV,където dv-малка промяна в обема на газа. Работата, извършена с крайни промени в обема, трябва да се изчисли чрез интегриране. Пълна удължаваща работа:
Помислете за процеса на разширяване на газа. Нека газ е затворен в цилиндричен съд, затворен с подвижно бутало (фиг. 39.1). Да приемем, че газът се разширява. Той ще движи буталото и ще работи върху него. С малка денивелация dxгаз ще свърши работа dA= fdx,където Ее силата, с която газът действа върху буталото, R -налягане на газа вначалото на пътуването dx.Следователно, dQ = pSdx = pdV,където dv-малка промяна в обема на газа. Работата, извършена с крайни промени в обема, трябва да се изчисли чрез интегриране. Пълна удължаваща работа:  .
.
 . [C]=J/K.
. [C]=J/K.
 . \u003d J / (mol K)
. \u003d J / (mol K) и
и  .
. .
. .
.

 Първият закон на термодинамиката в изобарен процес (p=const): .
Първият закон на термодинамиката в изобарен процес (p=const): .
 .
. .
.
 .
. ,
, (уравнение на Майер)
(уравнение на Майер) Първият закон на термодинамиката в изотермичен процес (T=const):
Първият закон на термодинамиката в изотермичен процес (T=const):  - топлината, предадена на системата по време на изотермичен процес, работи срещу външни сили:
- топлината, предадена на системата по време на изотермичен процес, работи срещу външни сили:
 .
. ; тези.
; тези.  (2)
(2) ;
;  (3)
(3) При сравняване на адиабатния и изотермичния процес се вижда, че адиабатът преминава по-стръмно от изотермата: за изотермата pV= const, за адиабатен
При сравняване на адиабатния и изотермичния процес се вижда, че адиабатът преминава по-стръмно от изотермата: за изотермата pV= const, за адиабатен  , и g>1, тоест налягането по време на адиабатния процес зависи по-силно.
, и g>1, тоест налягането по време на адиабатния процес зависи по-силно. . Първият закон за кръговите процеси е:
. Първият закон за кръговите процеси е:  .
. . Затворена крива в диаграмата, изобразяваща директен цикъл, е описана по посока на часовниковата стрелка. За да може системата да извършва положителна работа на цикъл, е необходимо разширението да се извършва при по-високи налягания от компресията.
. Затворена крива в диаграмата, изобразяваща директен цикъл, е описана по посока на часовниковата стрелка. За да може системата да извършва положителна работа на цикъл, е необходимо разширението да се извършва при по-високи налягания от компресията. (1)
(1) Ако при кръгов процес газът, разширявайки се, извършва по-малка работа от тази, която се произвежда от външни сили, когато се компресира, т.е. A 1<
A 2 , тогава такъв цикъл се нарича обратен. Може да възникне, когато разширяването на газа се извършва при по-ниска температура от компресията. В този случай газът отделя повече топлина, отколкото получава по време на разширението. Машините с обратен цикъл се наричат хладилни машини. AT
Ако при кръгов процес газът, разширявайки се, извършва по-малка работа от тази, която се произвежда от външни сили, когато се компресира, т.е. A 1<
A 2 , тогава такъв цикъл се нарича обратен. Може да възникне, когато разширяването на газа се извършва при по-ниска температура от компресията. В този случай газът отделя повече топлина, отколкото получава по време на разширението. Машините с обратен цикъл се наричат хладилни машини. AT  ; A 1 \u003d Q 1. (1)
; A 1 \u003d Q 1. (1) .
. ; A 2 \u003d Q 2. (2)
; A 2 \u003d Q 2. (2) (3)
(3) .
. .
.
 .
.
 (2)
(2) ,
, (3)
(3) (3)
(3) - средната кинетична енергия на хаотичното транслационно движение на една молекула, тогава основното уравнение ще бъде написано като:
- средната кинетична енергия на хаотичното транслационно движение на една молекула, тогава основното уравнение ще бъде написано като:  или
или 
 .
. , тогава .
, тогава . .
. - RMS скорост.
- RMS скорост. ,
,
 , (2.5)
, (2.5) е средната кинетична енергия на постъпателното движение на газовите молекули;
е средната кинетична енергия на постъпателното движение на газовите молекули; ,
(2.7)
,
(2.7) (2.8)
(2.8) - брой степени на свобода на постъпателно движение;
- брой степени на свобода на постъпателно движение; - брой степени на свобода на въртеливо движение;
- брой степени на свобода на въртеливо движение; - брой степени на свобода на колебателното движение;
- брой степени на свобода на колебателното движение; , а молекула с i степени на свобода има енергия
, а молекула с i степени на свобода има енергия (2.9)
(2.9) ,
(2.10)
,
(2.10) .
(2.11)
.
(2.11) (2.12)
(2.12) .
(2.13)
.
(2.13) .
.
 .
(2.14)
.
(2.14) ,
,
 .
(2.15)
.
(2.15) или
или  , (2.17)
, (2.17) (2.18)
(2.18) (2.19)
(2.19) (2.21)
(2.21) или
или  ,
(2.22)
,
(2.22) (2.23)
(2.23) ,
(2.24)
,
(2.24) ,
(2.28)
,
(2.28) , (2.30)
, (2.30) , докато dU = C v dT = 0,
, докато dU = C v dT = 0, .
(2.31)
.
(2.31) . (2.33)
. (2.33) .
(2.34)
.
(2.34) ,
,
 (2.35)
(2.35) ,
,
 .
(2.36)
.
(2.36)
 ;
;
 . (2.37)
. (2.37) .
(2.38)
.
(2.38) , (2.39)
, (2.39) (2.40)
(2.40) (2.42)
(2.42) .
(2.43)
.
(2.43) .
(2.44)
.
(2.44) (2.45)
(2.45) .
(2.46)
.
(2.46) .
(2.48)
.
(2.48) . (2.50)
. (2.50) .
(2.52)
.
(2.52) .
(2.53)
.
(2.53) ,
(2.54)
,
(2.54) ;
;
 .
(2.56)
.
(2.56) , (2.57)
, (2.57) .
(2.60)
.
(2.60) ,
(2.62)
,
(2.62) .
(2.63)
.
(2.63) ;
;
 ; Cp=(dH/dt). (2,64)
; Cp=(dH/dt). (2,64) ;
;
 .
(2.67)
.
(2.67) .
(2.68)
.
(2.68) .
(2.69)
.
(2.69) .
(2.70)
.
(2.70) , (2.71)
, (2.71) :
:
 ,
(2.72)
,
(2.72) ,
(2.73)
,
(2.73) , (2.74)
, (2.74) .
(2.75)
.
(2.75) .
(2.76)
.
(2.76) .
(2.77)
.
(2.77) .
(2.78)
.
(2.78) .
(2.79)
.
(2.79) ;
;
 ;
; ,
(2.81)
,
(2.81) ,
(2.82)
,
(2.82) или
или  ,
(2.83)
,
(2.83) ,
(2.85)
,
(2.85) ,
(2.86)
,
(2.86) ,
(2.87)
,
(2.87) ,
(2.88)
,
(2.88)
 .
(2.89)
.
(2.89) ; = D;
; = D;  .
(2.90)
.
(2.90) Молекулярната физика и термодинамиката са по същество две различни в своите подходи, но тясно свързани науки, които се занимават с едно и също нещо - изследване на макроскопичните свойства на физическите системи, но с напълно различни методи.
Молекулярната физика и термодинамиката са по същество две различни в своите подходи, но тясно свързани науки, които се занимават с едно и също нещо - изследване на макроскопичните свойства на физическите системи, но с напълно различни методи. Молекулярна физика Молекулярната физика или молекулярно-кинетична теория се основава на определени идеи за структурата на материята. – За установяване на законите на поведение на макроскопични системи, състоящи се от огромен брой частици, в молекулярната физика се използват различни модели на материята, например модели на идеален газ. Молекулярната физика е статистическа теория, физика, тоест теория, която разглежда поведението на системи, състоящи се от огромен брой частици (атоми, молекули), въз основа на вероятностни модели. Той се стреми, на базата на статистически подход, да установи връзка между експериментално измерените макроскопични величини (налягане, обем, температура и др.) и стойностите на микроскопичните характеристики на частиците, включени в микроскопичните характеристики на система (маса, импулс, енергия и т.н.) .
Молекулярна физика Молекулярната физика или молекулярно-кинетична теория се основава на определени идеи за структурата на материята. – За установяване на законите на поведение на макроскопични системи, състоящи се от огромен брой частици, в молекулярната физика се използват различни модели на материята, например модели на идеален газ. Молекулярната физика е статистическа теория, физика, тоест теория, която разглежда поведението на системи, състоящи се от огромен брой частици (атоми, молекули), въз основа на вероятностни модели. Той се стреми, на базата на статистически подход, да установи връзка между експериментално измерените макроскопични величини (налягане, обем, температура и др.) и стойностите на микроскопичните характеристики на частиците, включени в микроскопичните характеристики на система (маса, импулс, енергия и т.н.) . Термодинамика За разлика от молекулярно-кинетичната теория, термодинамиката, когато изучава термодинамичните свойства на макроскопичните системи, не разчита на никакви идеи за молекулярната структура на веществото. Термодинамиката е феноменологична наука. - Прави изводи за свойствата на материята въз основа на закони, установени от опита, като например закона за запазване на енергията. Термодинамиката оперира само с макроскопични величини (налягане, температура, обем и др.), които се въвеждат на базата на физичен експеримент.
Термодинамика За разлика от молекулярно-кинетичната теория, термодинамиката, когато изучава термодинамичните свойства на макроскопичните системи, не разчита на никакви идеи за молекулярната структура на веществото. Термодинамиката е феноменологична наука. - Прави изводи за свойствата на материята въз основа на закони, установени от опита, като например закона за запазване на енергията. Термодинамиката оперира само с макроскопични величини (налягане, температура, обем и др.), които се въвеждат на базата на физичен експеримент. И двата подхода – термодинамичен и статистически – не си противоречат, а се допълват. Само комбинираното използване на термодинамиката и молекулярно-кинетичната теория може да даде най-пълна картина на свойствата на системи, състоящи се от голям брой частици.
И двата подхода – термодинамичен и статистически – не си противоречат, а се допълват. Само комбинираното използване на термодинамиката и молекулярно-кинетичната теория може да даде най-пълна картина на свойствата на системи, състоящи се от голям брой частици. Молекулярна физика Молекулярно-кинетичната теория е изследване на структурата и свойствата на материята въз основа на концепцията за съществуването на атоми и молекули като най-малките частици от химични вещества.
Молекулярна физика Молекулярно-кинетичната теория е изследване на структурата и свойствата на материята въз основа на концепцията за съществуването на атоми и молекули като най-малките частици от химични вещества. Молекулярно-кинетична теория Основни положения на MKT 1. Всички вещества - течни, твърди и газообразни - се образуват от най-малките частици - молекули, които сами се състоят от атоми ("елементарни молекули"). Молекулите на химичното вещество могат да бъдат прости и сложни, т.е. да се състоят от един или повече атоми. Молекулите и атомите са електрически неутрални частици. При определени условия молекулите и атомите могат да придобият допълнителен електрически заряд и да се превърнат в положителни или отрицателни йони. 2. Атомите и молекулите са в непрекъснато хаотично движение, което се нарича топлинно движение. 3. Частиците взаимодействат една с друга чрез сили, които са електрически по природа. Гравитационното взаимодействие между частиците е незначително.
Молекулярно-кинетична теория Основни положения на MKT 1. Всички вещества - течни, твърди и газообразни - се образуват от най-малките частици - молекули, които сами се състоят от атоми ("елементарни молекули"). Молекулите на химичното вещество могат да бъдат прости и сложни, т.е. да се състоят от един или повече атоми. Молекулите и атомите са електрически неутрални частици. При определени условия молекулите и атомите могат да придобият допълнителен електрически заряд и да се превърнат в положителни или отрицателни йони. 2. Атомите и молекулите са в непрекъснато хаотично движение, което се нарича топлинно движение. 3. Частиците взаимодействат една с друга чрез сили, които са електрически по природа. Гравитационното взаимодействие между частиците е незначително. Молекулярно-кинетична теория Най-яркото експериментално потвърждение на идеите на молекулярно-кинетичната теория за хаотичното движение на атомите и молекулите е Брауновото движение. Брауновото движение е топлинното движение на най-малките микроскопични частици, суспендирани в течност или газ. Открит е от английския ботаник Р. Браун през 1827 г. Брауновите частици се движат под въздействието на случайни сблъсъци на молекули. Поради хаотичното топлинно движение на молекулите, тези удари никога не се компенсират взаимно. В резултат на това скоростта на браунова частица произволно се променя по величина и посока, а траекторията й е сложна зигзагообразна крива (фиг.). Теорията за брауновото движение е създадена от А. Айнщайн през 1905 г. Теорията на Айнщайн е експериментално потвърдена в експериментите на френския физик Ж. Перин, проведени през 1908–1911 г.
Молекулярно-кинетична теория Най-яркото експериментално потвърждение на идеите на молекулярно-кинетичната теория за хаотичното движение на атомите и молекулите е Брауновото движение. Брауновото движение е топлинното движение на най-малките микроскопични частици, суспендирани в течност или газ. Открит е от английския ботаник Р. Браун през 1827 г. Брауновите частици се движат под въздействието на случайни сблъсъци на молекули. Поради хаотичното топлинно движение на молекулите, тези удари никога не се компенсират взаимно. В резултат на това скоростта на браунова частица произволно се променя по величина и посока, а траекторията й е сложна зигзагообразна крива (фиг.). Теорията за брауновото движение е създадена от А. Айнщайн през 1905 г. Теорията на Айнщайн е експериментално потвърдена в експериментите на френския физик Ж. Перин, проведени през 1908–1911 г. Молекулярно-кинетична теория Постоянното хаотично движение на молекулите на дадено вещество се проявява и в друго лесно забележимо явление - дифузията. Дифузията е явлението на проникване на две или повече съседни вещества на приятел. - Процесът протича най-бързо в газ, ако това е газ, който е разнороден по състав. Дифузията води до образуването на хомогенна смес, независимо от плътността на компонентите. Така че, ако в две части на съда, разделени от преграда, има кислород О 2 и водород Н 2, тогава след отстраняването на преградата започва процесът на взаимно проникване на газовете на другия, което води до образуването на експлозив смес - експлозивен газ. Този процес се случва и когато лек газ (водород) е в горната половина на съда, а по-тежък (кислород) е в долната половина.
Молекулярно-кинетична теория Постоянното хаотично движение на молекулите на дадено вещество се проявява и в друго лесно забележимо явление - дифузията. Дифузията е явлението на проникване на две или повече съседни вещества на приятел. - Процесът протича най-бързо в газ, ако това е газ, който е разнороден по състав. Дифузията води до образуването на хомогенна смес, независимо от плътността на компонентите. Така че, ако в две части на съда, разделени от преграда, има кислород О 2 и водород Н 2, тогава след отстраняването на преградата започва процесът на взаимно проникване на газовете на другия, което води до образуването на експлозив смес - експлозивен газ. Този процес се случва и когато лек газ (водород) е в горната половина на съда, а по-тежък (кислород) е в долната половина. Молекулярно-кинетична теория - Подобни процеси в течности протичат много по-бавно. Взаимното проникване на две течности от различни течности една в друга, разтварянето на твърди вещества в течности (например захар във вода) и образуването на хомогенни разтвори са примери за дифузионни процеси в течности. В реални условия дифузията в течности и газове се маскира от по-бързи процеси на смесване, например поради появата на конвекционни токове.
Молекулярно-кинетична теория - Подобни процеси в течности протичат много по-бавно. Взаимното проникване на две течности от различни течности една в друга, разтварянето на твърди вещества в течности (например захар във вода) и образуването на хомогенни разтвори са примери за дифузионни процеси в течности. В реални условия дифузията в течности и газове се маскира от по-бързи процеси на смесване, например поради появата на конвекционни токове. Молекулярно-кинетична теория - Най-бавният процес на дифузия протича в твърди вещества. Експериментите обаче показват, че когато твърдите вещества влязат в контакт с добре почистени повърхности на два метала, след дълго време във всеки от тях се откриват атоми на друг метал. Дифузия и Брауново движение - Дифузията и Брауновото движение са свързани явления. Взаимното проникване на контактни вещества на приятел и произволното движение на най-малките частици, суспендирани в течност или газ, възникват поради хаотичното топлинно движение на молекулите.
Молекулярно-кинетична теория - Най-бавният процес на дифузия протича в твърди вещества. Експериментите обаче показват, че когато твърдите вещества влязат в контакт с добре почистени повърхности на два метала, след дълго време във всеки от тях се откриват атоми на друг метал. Дифузия и Брауново движение - Дифузията и Брауновото движение са свързани явления. Взаимното проникване на контактни вещества на приятел и произволното движение на най-малките частици, суспендирани в течност или газ, възникват поради хаотичното топлинно движение на молекулите. Молекулярно-кинетична теория Силите, действащи между две молекули Силите, действащи между две молекули, зависят от разстоянието между тях. Молекулите са сложни пространствени структури, съдържащи както положителни, така и отрицателни заряди. Ако разстоянието между молекулите е достатъчно голямо, тогава преобладават силите на междумолекулно привличане. На малки разстояния преобладават силите на отблъскване.
Молекулярно-кинетична теория Силите, действащи между две молекули Силите, действащи между две молекули, зависят от разстоянието между тях. Молекулите са сложни пространствени структури, съдържащи както положителни, така и отрицателни заряди. Ако разстоянието между молекулите е достатъчно голямо, тогава преобладават силите на междумолекулно привличане. На малки разстояния преобладават силите на отблъскване. Молекулярно-кинетична теория На определено разстояние r = r 0 силата на взаимодействие изчезва. Това разстояние условно може да се приеме за диаметър на молекулата. Потенциалната енергия на взаимодействие при r = r 0 е минимална. За да премахнете две молекули, които са на разстояние r 0 една от друга, трябва да им дадете допълнителна енергия E 0. Стойността на E 0 се нарича дълбочина на потенциалната яма или енергия на свързване. Молекулите са изключително малки. Простите едноатомни молекули са с размер около 10–10 м. Сложните многоатомни молекули могат да бъдат стотици или хиляди пъти по-големи.
Молекулярно-кинетична теория На определено разстояние r = r 0 силата на взаимодействие изчезва. Това разстояние условно може да се приеме за диаметър на молекулата. Потенциалната енергия на взаимодействие при r = r 0 е минимална. За да премахнете две молекули, които са на разстояние r 0 една от друга, трябва да им дадете допълнителна енергия E 0. Стойността на E 0 се нарича дълбочина на потенциалната яма или енергия на свързване. Молекулите са изключително малки. Простите едноатомни молекули са с размер около 10–10 м. Сложните многоатомни молекули могат да бъдат стотици или хиляди пъти по-големи. Молекулярно-кинетична теория Кинетичната енергия на топлинното движение се увеличава с повишаване на температурата. При ниски температури средната кинетична енергия на молекулата може да се окаже по-малка от дълбочината на потенциалната яма E 0. В този случай молекулите се кондензират в течност или твърдо вещество; в този случай средното разстояние между молекулите ще бъде приблизително равно на r 0. С повишаването на температурата средната кинетична енергия на молекулата става по-голяма от E 0, молекулите се разлитат и се образува газообразно вещество
Молекулярно-кинетична теория Кинетичната енергия на топлинното движение се увеличава с повишаване на температурата. При ниски температури средната кинетична енергия на молекулата може да се окаже по-малка от дълбочината на потенциалната яма E 0. В този случай молекулите се кондензират в течност или твърдо вещество; в този случай средното разстояние между молекулите ще бъде приблизително равно на r 0. С повишаването на температурата средната кинетична енергия на молекулата става по-голяма от E 0, молекулите се разлитат и се образува газообразно вещество Молекулярно-кинетична теория Агрегатни състояния на материята В твърдите тела молекулите извършват произволни вибрации около фиксирани центрове (равновесни позиции) в твърдите тела. Тези центрове могат да бъдат разположени в пространството по неправилен начин (аморфни тела) или да образуват подредени обемни структури (кристални тела). Следователно твърдите тела запазват както формата, така и обема.
Молекулярно-кинетична теория Агрегатни състояния на материята В твърдите тела молекулите извършват произволни вибрации около фиксирани центрове (равновесни позиции) в твърдите тела. Тези центрове могат да бъдат разположени в пространството по неправилен начин (аморфни тела) или да образуват подредени обемни структури (кристални тела). Следователно твърдите тела запазват както формата, така и обема. Молекулярно-кинетична теория Агрегатни състояния на материята В течностите молекулите имат много по-голяма свобода за топлинно движение. Те не са обвързани с определени центрове и могат да се движат в целия обем. Това обяснява течливостта на течностите. Близко разположените течни молекули също могат да образуват подредени структури, съдържащи няколко молекули. Това явление се нарича близък ред, за разлика от далечния ред, характерен за кристалните тела. Следователно течностите не запазват формата си, но запазват обема си.
Молекулярно-кинетична теория Агрегатни състояния на материята В течностите молекулите имат много по-голяма свобода за топлинно движение. Те не са обвързани с определени центрове и могат да се движат в целия обем. Това обяснява течливостта на течностите. Близко разположените течни молекули също могат да образуват подредени структури, съдържащи няколко молекули. Това явление се нарича близък ред, за разлика от далечния ред, характерен за кристалните тела. Следователно течностите не запазват формата си, но запазват обема си. Молекулярно-кинетична теория Агрегатни състояния на материята В газовете разстоянията между молекулите обикновено са много по-големи от техните размери. Силите на взаимодействие между молекулите на толкова големи разстояния са малки и всяка молекула се движи по права линия до следващия сблъсък с друга молекула или със стената на съда. - Средното разстояние между молекулите на въздуха при нормални условия е около 10–8 m, т.е. десет пъти по-голямо от размера на молекулите. Слабото взаимодействие между молекулите обяснява способността на газовете да се разширяват и да запълват целия обем на съда. В границата, когато взаимодействието клони към нула, стигаме до концепцията за идеален газ. Следователно газовете не запазват нито форма, нито обем.
Молекулярно-кинетична теория Агрегатни състояния на материята В газовете разстоянията между молекулите обикновено са много по-големи от техните размери. Силите на взаимодействие между молекулите на толкова големи разстояния са малки и всяка молекула се движи по права линия до следващия сблъсък с друга молекула или със стената на съда. - Средното разстояние между молекулите на въздуха при нормални условия е около 10–8 m, т.е. десет пъти по-голямо от размера на молекулите. Слабото взаимодействие между молекулите обяснява способността на газовете да се разширяват и да запълват целия обем на съда. В границата, когато взаимодействието клони към нула, стигаме до концепцията за идеален газ. Следователно газовете не запазват нито форма, нито обем. Молекулярно-кинетична теория Количество вещество В молекулярно-кинетичната теория се счита, че количеството вещество е пропорционално на броя на частиците на веществото. Единицата за количество на дадено вещество се нарича мол (мол). Един мол е количеството вещество, което съдържа толкова частици (молекули), колкото има атоми 0,012 kg въглерод 12 C. (Въглеродната молекула се състои от един атом) По този начин един мол от всяко вещество съдържа същия брой частици ( молекули). Това число се нарича константа на Авогадро NA: NA = 6,02 1023 mol–1 Константата на Авогадро е една от най-важните константи в молекулярно-кинетичната теория.
Молекулярно-кинетична теория Количество вещество В молекулярно-кинетичната теория се счита, че количеството вещество е пропорционално на броя на частиците на веществото. Единицата за количество на дадено вещество се нарича мол (мол). Един мол е количеството вещество, което съдържа толкова частици (молекули), колкото има атоми 0,012 kg въглерод 12 C. (Въглеродната молекула се състои от един атом) По този начин един мол от всяко вещество съдържа същия брой частици ( молекули). Това число се нарича константа на Авогадро NA: NA = 6,02 1023 mol–1 Константата на Авогадро е една от най-важните константи в молекулярно-кинетичната теория. Молекулярно-кинетична теория Количеството вещество ν се определя като съотношението на броя N на частиците (молекулите) на веществото към константата на Авогадро NA: Масата на един мол вещество обикновено се нарича моларна маса M Моларна масата е равна на произведението на масата m 0 на една молекула от дадено вещество по константата на Авогадро: M = NA · m 0 Моларната маса се изразява в килограми на мол (kg/mol). За вещества, чиито молекули се състоят от един атом, често се използва терминът атомна маса. 1/12 от масата на атом на въглеродния изотоп 12 C (с масово число 12) се приема като единица маса на атоми и молекули. Тази единица се нарича единица за атомна маса (a.m.u.): 1 сутринта. е. м. = 1,66 10–27 кг. Тази стойност почти съвпада с масата на протон или неутрон. Съотношението на масата на атом или молекула на дадено вещество към 1/12 от масата на въглероден атом 12 C се нарича относителна маса.
Молекулярно-кинетична теория Количеството вещество ν се определя като съотношението на броя N на частиците (молекулите) на веществото към константата на Авогадро NA: Масата на един мол вещество обикновено се нарича моларна маса M Моларна масата е равна на произведението на масата m 0 на една молекула от дадено вещество по константата на Авогадро: M = NA · m 0 Моларната маса се изразява в килограми на мол (kg/mol). За вещества, чиито молекули се състоят от един атом, често се използва терминът атомна маса. 1/12 от масата на атом на въглеродния изотоп 12 C (с масово число 12) се приема като единица маса на атоми и молекули. Тази единица се нарича единица за атомна маса (a.m.u.): 1 сутринта. е. м. = 1,66 10–27 кг. Тази стойност почти съвпада с масата на протон или неутрон. Съотношението на масата на атом или молекула на дадено вещество към 1/12 от масата на въглероден атом 12 C се нарича относителна маса. Молекулярно-кинетична теория Най-простият модел, разглеждан от молекулярно-кинетичната теория, е моделът на идеалния газ: 1. В идеалния газов кинетичен модел, молекулите 1. се разглеждат като идеално еластични топки, взаимодействащи една с друга и със стените само по време на еластични сблъсъци. 2. Приема се, че общият обем на всички молекули е малък в сравнение с 2. обема на съда, съдържащ газа. Моделът на идеалния газ описва доста добре поведението на реалните газове в широк диапазон от налягания и температури. Задачата на молекулярно-кинетичната теория е да установи връзка между микроскопични (маса, микроскопична скорост, кинетична енергия на молекулите) и макроскопични параметри (налягане, обем, макроскопични температурни параметри).
Молекулярно-кинетична теория Най-простият модел, разглеждан от молекулярно-кинетичната теория, е моделът на идеалния газ: 1. В идеалния газов кинетичен модел, молекулите 1. се разглеждат като идеално еластични топки, взаимодействащи една с друга и със стените само по време на еластични сблъсъци. 2. Приема се, че общият обем на всички молекули е малък в сравнение с 2. обема на съда, съдържащ газа. Моделът на идеалния газ описва доста добре поведението на реалните газове в широк диапазон от налягания и температури. Задачата на молекулярно-кинетичната теория е да установи връзка между микроскопични (маса, микроскопична скорост, кинетична енергия на молекулите) и макроскопични параметри (налягане, обем, макроскопични температурни параметри). Молекулярно-кинетична теория В резултат на всеки сблъсък между молекули и молекули със стени, скоростите на молекулите могат да се променят по големина и посока; на интервалите от време между последователните сблъсъци молекулите се движат равномерно и праволинейно. В модела на идеалния газ се приема, че всички сблъсъци се случват според законите на еластичния удар, т.е. те се подчиняват на законите на Нютоновата механика. Използвайки модела на идеалния газ, изчисляваме налягането на газа върху стената на съда. В процеса на взаимодействие на молекула със стената на съда между тях възникват сили, които се подчиняват на третия закон на Нютон. В резултат на това проекцията υx на скоростта на молекулата, перпендикулярна на стената, променя знака си на противоположния, докато проекцията υy на скоростта, успоредна на стената, остава непроменена (фиг.).
Молекулярно-кинетична теория В резултат на всеки сблъсък между молекули и молекули със стени, скоростите на молекулите могат да се променят по големина и посока; на интервалите от време между последователните сблъсъци молекулите се движат равномерно и праволинейно. В модела на идеалния газ се приема, че всички сблъсъци се случват според законите на еластичния удар, т.е. те се подчиняват на законите на Нютоновата механика. Използвайки модела на идеалния газ, изчисляваме налягането на газа върху стената на съда. В процеса на взаимодействие на молекула със стената на съда между тях възникват сили, които се подчиняват на третия закон на Нютон. В резултат на това проекцията υx на скоростта на молекулата, перпендикулярна на стената, променя знака си на противоположния, докато проекцията υy на скоростта, успоредна на стената, остава непроменена (фиг.). Молекулярно-кинетична теория Формулата за средното налягане на газ върху стената на съд се записва като Това уравнение установява връзката между налягането p на идеален газ, масата на молекулата m 0, концентрацията на молекулите n, средна стойност на квадрата на скоростта и средната кинетична енергия на постъпателното движение на молекулите. Това е основното уравнение на молекулярно-кинетичната теория на газовете.Така налягането на газа е равно на две трети от средната кинетична енергия на постъпателното движение на молекулите, съдържащи се в единица обем.
Молекулярно-кинетична теория Формулата за средното налягане на газ върху стената на съд се записва като Това уравнение установява връзката между налягането p на идеален газ, масата на молекулата m 0, концентрацията на молекулите n, средна стойност на квадрата на скоростта и средната кинетична енергия на постъпателното движение на молекулите. Това е основното уравнение на молекулярно-кинетичната теория на газовете.Така налягането на газа е равно на две трети от средната кинетична енергия на постъпателното движение на молекулите, съдържащи се в единица обем. Молекулярно-кинетична теория Основното уравнение на MCT на газовете включва произведението на концентрацията на молекулите n и средната кинетична енергия на транслационното движение. В този случай налягането е пропорционално на средната кинетична енергия. Възникват въпроси: как може експериментално да се промени средната кинетична енергия на движението на молекулите в съд с постоянен обем? Какво физическо количество трябва да се промени, за да се промени средната кинетична енергия? Опитът показва, че температурата е такава величина.
Молекулярно-кинетична теория Основното уравнение на MCT на газовете включва произведението на концентрацията на молекулите n и средната кинетична енергия на транслационното движение. В този случай налягането е пропорционално на средната кинетична енергия. Възникват въпроси: как може експериментално да се промени средната кинетична енергия на движението на молекулите в съд с постоянен обем? Какво физическо количество трябва да се промени, за да се промени средната кинетична енергия? Опитът показва, че температурата е такава величина. Молекулярно-кинетична теория Температура Концепцията за температура е тясно свързана с концепцията за топлинно равновесие. Телата в контакт едно с друго могат да обменят енергия. Енергията, прехвърлена от едно тяло на друго по време на топлинен контакт, се нарича количеството топлина Q. Топлинното равновесие е такова състояние на система от тела в топлинен контакт, при което няма пренос на топлина от едно тяло към друго и всички макроскопични параметри на телата остават непроменени. Температурата е физичен параметър, който е еднакъв за температурата на всички тела в топлинно равновесие. Възможността за въвеждане на понятието температура произтича от опита и се нарича нулев закон на термодинамиката.
Молекулярно-кинетична теория Температура Концепцията за температура е тясно свързана с концепцията за топлинно равновесие. Телата в контакт едно с друго могат да обменят енергия. Енергията, прехвърлена от едно тяло на друго по време на топлинен контакт, се нарича количеството топлина Q. Топлинното равновесие е такова състояние на система от тела в топлинен контакт, при което няма пренос на топлина от едно тяло към друго и всички макроскопични параметри на телата остават непроменени. Температурата е физичен параметър, който е еднакъв за температурата на всички тела в топлинно равновесие. Възможността за въвеждане на понятието температура произтича от опита и се нарича нулев закон на термодинамиката. Молекулярно-кинетична теория Температура За измерване на температурата се използват физически инструменти - термометри, при които стойността на температурата се определя от промяната на някакъв физичен параметър. За да създадете термометър, е необходимо да изберете термометрично вещество (например живак, алкохол) и термометрично количество, което характеризира свойството на веществото (например дължината на живачен или алкохолен стълб). Различните конструкции на термометри използват различни физични свойства на дадено вещество (например промяна в линейните размери на твърди тела или промяна в електрическото съпротивление на проводниците при нагряване). Термометрите трябва да бъдат калибрирани.
Молекулярно-кинетична теория Температура За измерване на температурата се използват физически инструменти - термометри, при които стойността на температурата се определя от промяната на някакъв физичен параметър. За да създадете термометър, е необходимо да изберете термометрично вещество (например живак, алкохол) и термометрично количество, което характеризира свойството на веществото (например дължината на живачен или алкохолен стълб). Различните конструкции на термометри използват различни физични свойства на дадено вещество (например промяна в линейните размери на твърди тела или промяна в електрическото съпротивление на проводниците при нагряване). Термометрите трябва да бъдат калибрирани. Молекулярно-кинетична теория Специално място във физиката заемат газовите термометри (фиг.), В които термометричното вещество е разреден газ (хелий, въздух) в съд с постоянен обем (V = const), а термометричното количество е налягането на газа p. Опитът показва, че налягането на газа (при V = const) нараства с повишаване на температурата, измерено в Целзий.
Молекулярно-кинетична теория Специално място във физиката заемат газовите термометри (фиг.), В които термометричното вещество е разреден газ (хелий, въздух) в съд с постоянен обем (V = const), а термометричното количество е налягането на газа p. Опитът показва, че налягането на газа (при V = const) нараства с повишаване на температурата, измерено в Целзий. Молекулярно-кинетична теория За да калибрирате газов термометър с постоянен обем, можете да измерите налягането при две температури (например 0 °C и 100 °C), да начертаете точките p 0 и p 100 на графика и след това да начертаете права линия между тях (фиг. ). С помощта на така получената калибровъчна крива могат да се определят температурите, съответстващи на други налягания. Чрез екстраполиране на графиката в областта на ниското налягане е възможно да се екстраполира графиката в областта на ниското налягане, за да се определи някаква "хипотетична" температура, при която налягането на газа ще стане равно на нула. Опитът показва, че тази температура е равна на -273,15 °C и не зависи от свойствата на газа. На практика е невъзможно чрез охлаждане да се получи газ в състояние с нулево налягане, тъй като при много ниски температури всички газове преминават в течно или твърдо състояние.
Молекулярно-кинетична теория За да калибрирате газов термометър с постоянен обем, можете да измерите налягането при две температури (например 0 °C и 100 °C), да начертаете точките p 0 и p 100 на графика и след това да начертаете права линия между тях (фиг. ). С помощта на така получената калибровъчна крива могат да се определят температурите, съответстващи на други налягания. Чрез екстраполиране на графиката в областта на ниското налягане е възможно да се екстраполира графиката в областта на ниското налягане, за да се определи някаква "хипотетична" температура, при която налягането на газа ще стане равно на нула. Опитът показва, че тази температура е равна на -273,15 °C и не зависи от свойствата на газа. На практика е невъзможно чрез охлаждане да се получи газ в състояние с нулево налягане, тъй като при много ниски температури всички газове преминават в течно или твърдо състояние. Молекулярно-кинетична теория Английският физик У. Келвин (Томсън) през 1848 г. предлага да се използва точката на нулево налягане на газа за изграждане на нова температурна скала (скалата на Келвин). В тази скала температурната единица е същата като в скалата на Целзий, но нулевата точка е изместена: TK = TC + 273, 15. В системата SI температурната единица по скалата на Келвин се нарича келвин и се обозначава с буквата K , Например стайна температура TC \u003d 20 ° С по скалата на Келвин е равна на TK \u003d 293,15 K.
Молекулярно-кинетична теория Английският физик У. Келвин (Томсън) през 1848 г. предлага да се използва точката на нулево налягане на газа за изграждане на нова температурна скала (скалата на Келвин). В тази скала температурната единица е същата като в скалата на Целзий, но нулевата точка е изместена: TK = TC + 273, 15. В системата SI температурната единица по скалата на Келвин се нарича келвин и се обозначава с буквата K , Например стайна температура TC \u003d 20 ° С по скалата на Келвин е равна на TK \u003d 293,15 K. Молекулярно-кинетична теория Температурната скала на Келвин се нарича абсолютна температурна скала. Оказва се, че това е най-удобната температурна скала за изграждане на физични теории. Няма нужда да обвързвате скалата на Келвин с две фиксирани точки - точката на топене на леда и точката на кипене на водата при нормално атмосферно налягане, както е обичайно в скалата на Целзий. В допълнение към точката на нулево налягане на газа, която се нарича абсолютна нула на температурата, е достатъчно да се вземе още една фиксирана референтна точка като абсолютна нула на температурата. В скалата на Келвин температурата на тройната точка на водата (0,01 ° C) се използва като такава точка, в която и трите фази са в топлинно равновесие - лед, вода и пара. По скалата на Келвин температурата на тройната точка се приема за 273,16 K.
Молекулярно-кинетична теория Температурната скала на Келвин се нарича абсолютна температурна скала. Оказва се, че това е най-удобната температурна скала за изграждане на физични теории. Няма нужда да обвързвате скалата на Келвин с две фиксирани точки - точката на топене на леда и точката на кипене на водата при нормално атмосферно налягане, както е обичайно в скалата на Целзий. В допълнение към точката на нулево налягане на газа, която се нарича абсолютна нула на температурата, е достатъчно да се вземе още една фиксирана референтна точка като абсолютна нула на температурата. В скалата на Келвин температурата на тройната точка на водата (0,01 ° C) се използва като такава точка, в която и трите фази са в топлинно равновесие - лед, вода и пара. По скалата на Келвин температурата на тройната точка се приема за 273,16 K. Молекулярно-кинетична теория По този начин налягането на разреден газ в съд с постоянен обем V се променя право пропорционално на неговата абсолютна температура: p ~ T. T ν в даден съд към обема V на съда, където N е числото на молекулите в съда, NA е константата на Авогадро, n = N / V е концентрацията на молекулите (т.е. броят на молекулите на единица обем на съда).
Молекулярно-кинетична теория По този начин налягането на разреден газ в съд с постоянен обем V се променя право пропорционално на неговата абсолютна температура: p ~ T. T ν в даден съд към обема V на съда, където N е числото на молекулите в съда, NA е константата на Авогадро, n = N / V е концентрацията на молекулите (т.е. броят на молекулите на единица обем на съда). Молекулярно-кинетична теория Комбинирайки тези отношения на пропорционалност, можем да запишем: p = nk. T, където k е някаква постоянна стойност, която е универсална за всички газове. Нарича се константа на Болцман в чест на австрийския физик Л. Болцман, един от създателите на MKT. Константата на Болцман е една от основните физически константи. Числената му стойност в SI: k = 1,38·10–23 J/K.
Молекулярно-кинетична теория Комбинирайки тези отношения на пропорционалност, можем да запишем: p = nk. T, където k е някаква постоянна стойност, която е универсална за всички газове. Нарича се константа на Болцман в чест на австрийския физик Л. Болцман, един от създателите на MKT. Константата на Болцман е една от основните физически константи. Числената му стойност в SI: k = 1,38·10–23 J/K. Молекулярно-кинетична теория Сравняване на съотношенията p = nk. T с основното уравнение на MKT газовете, можете да получите: Средната кинетична енергия на хаотичното движение на газовите молекули е право пропорционална на абсолютната температура. По този начин температурата е мярка за средната кинетична енергия на постъпателното движение на молекулите.Трябва да се отбележи, че средната кинетична енергия на постъпателното движение на молекулата не зависи от нейната маса. Браунова частица, суспендирана в течност или газ, има същата средна кинетична енергия като отделна молекула, чиято маса е с много порядъци по-малка от масата на браунова частица.
Молекулярно-кинетична теория Сравняване на съотношенията p = nk. T с основното уравнение на MKT газовете, можете да получите: Средната кинетична енергия на хаотичното движение на газовите молекули е право пропорционална на абсолютната температура. По този начин температурата е мярка за средната кинетична енергия на постъпателното движение на молекулите.Трябва да се отбележи, че средната кинетична енергия на постъпателното движение на молекулата не зависи от нейната маса. Браунова частица, суспендирана в течност или газ, има същата средна кинетична енергия като отделна молекула, чиято маса е с много порядъци по-малка от масата на браунова частица. Молекулярно-кинетична теория Това заключение важи и за случая, когато съдът съдържа смес от химически невзаимодействащи си газове, чиито молекули имат различни маси. В състояние на равновесие молекулите на различни газове ще имат еднакви средни кинетични енергии на топлинно движение, определени само от температурата на сместа. Налягането на сместа от газове върху стените на съда ще бъде сумата от парциалните налягания на всеки газ: p = p 1 + p 2 + p 3 + ... = (n 1 + n 2 + n 3 + ...)к. T В това отношение n 1, n 2, n 3, … са концентрациите на молекули на различни газове в сместа. Тази връзка изразява на езика на молекулярно-кинетичната теория закона на Далтон, експериментално установен в началото на 19 век: налягането в смес от закона на Далтон на химически невзаимодействащи газове е равно на сумата от техните парциални налягания.
Молекулярно-кинетична теория Това заключение важи и за случая, когато съдът съдържа смес от химически невзаимодействащи си газове, чиито молекули имат различни маси. В състояние на равновесие молекулите на различни газове ще имат еднакви средни кинетични енергии на топлинно движение, определени само от температурата на сместа. Налягането на сместа от газове върху стените на съда ще бъде сумата от парциалните налягания на всеки газ: p = p 1 + p 2 + p 3 + ... = (n 1 + n 2 + n 3 + ...)к. T В това отношение n 1, n 2, n 3, … са концентрациите на молекули на различни газове в сместа. Тази връзка изразява на езика на молекулярно-кинетичната теория закона на Далтон, експериментално установен в началото на 19 век: налягането в смес от закона на Далтон на химически невзаимодействащи газове е равно на сумата от техните парциални налягания. Молекулярно-кинетична теория Уравнение на състоянието на идеален газ Съотношение p = nk. T може да бъде записано в друга форма, която установява връзка между макроскопичните параметри на газа - обем V, налягане p, температура T и количеството вещество ν = m / M. M - Тази връзка се нарича уравнение на състоянието на идеалния газ или уравнението на състоянието на идеалния газ на Клапейрон–Менделеев – Произведението на константата на Авогадро NA и константата на Болцман k се нарича универсална газова константа и се обозначава с буквата R. Нейната числена стойност в SI е: R = k ∙NA = 8,31 J/mol·K.
Молекулярно-кинетична теория Уравнение на състоянието на идеален газ Съотношение p = nk. T може да бъде записано в друга форма, която установява връзка между макроскопичните параметри на газа - обем V, налягане p, температура T и количеството вещество ν = m / M. M - Тази връзка се нарича уравнение на състоянието на идеалния газ или уравнението на състоянието на идеалния газ на Клапейрон–Менделеев – Произведението на константата на Авогадро NA и константата на Болцман k се нарича универсална газова константа и се обозначава с буквата R. Нейната числена стойност в SI е: R = k ∙NA = 8,31 J/mol·K. Молекулярно-кинетична теория Уравнението на състоянието на идеален газ - Ако температурата на газа е Tn = 273,15 K (0 ° C) и налягането pn = 1 atm = 1,013 105 Pa, тогава те казват, че газът е при нормални условия . Както следва от уравнението на състоянието за идеален газ, един мол от всеки газ при нормални условия заема същия обем V 0 \u003d 0,0224 m 3 / mol \u003d 22,4 dm 3 / mol. Това твърдение се нарича закон на Авогадро.
Молекулярно-кинетична теория Уравнението на състоянието на идеален газ - Ако температурата на газа е Tn = 273,15 K (0 ° C) и налягането pn = 1 atm = 1,013 105 Pa, тогава те казват, че газът е при нормални условия . Както следва от уравнението на състоянието за идеален газ, един мол от всеки газ при нормални условия заема същия обем V 0 \u003d 0,0224 m 3 / mol \u003d 22,4 dm 3 / mol. Това твърдение се нарича закон на Авогадро. Молекулярно-кинетична теория Изопроцеси Газът може да участва в различни топлинни процеси, при които всички параметри, описващи неговото състояние (p, V и T) могат да се променят. Ако процесът протича достатъчно бавно, тогава във всеки един момент системата е близо до равновесното си състояние. Такива процеси се наричат квазистатични. В обичайния за нас квазистатичен времеви мащаб тези процеси могат да протичат не много бавно. Например разреждането и компресирането на газ в звукова вълна, което се случва стотици пъти в секунда, може да се разглежда като квазистатичен процес. Квазистатичните процеси могат да бъдат изобразени на диаграма на състоянието (например в p, V координати) като определена траектория, всяка точка от която представлява равновесно състояние. Интерес представляват процеси, при които един от параметрите (p, V или T) остава непроменен. Такива процеси се наричат изопроцеси.
Молекулярно-кинетична теория Изопроцеси Газът може да участва в различни топлинни процеси, при които всички параметри, описващи неговото състояние (p, V и T) могат да се променят. Ако процесът протича достатъчно бавно, тогава във всеки един момент системата е близо до равновесното си състояние. Такива процеси се наричат квазистатични. В обичайния за нас квазистатичен времеви мащаб тези процеси могат да протичат не много бавно. Например разреждането и компресирането на газ в звукова вълна, което се случва стотици пъти в секунда, може да се разглежда като квазистатичен процес. Квазистатичните процеси могат да бъдат изобразени на диаграма на състоянието (например в p, V координати) като определена траектория, всяка точка от която представлява равновесно състояние. Интерес представляват процеси, при които един от параметрите (p, V или T) остава непроменен. Такива процеси се наричат изопроцеси. Изотермичен процес (T = const) Изотермичният процес е квазистатичен процес, който протича при постоянна температура T. От уравнението на състоянието на идеален газ следва, че при постоянна температура T и T, постоянно количество вещество ν в съда произведението от налягането p на газа и неговия p обем V трябва да остане постоянно: p. V = const
Изотермичен процес (T = const) Изотермичният процес е квазистатичен процес, който протича при постоянна температура T. От уравнението на състоянието на идеален газ следва, че при постоянна температура T и T, постоянно количество вещество ν в съда произведението от налягането p на газа и неговия p обем V трябва да остане постоянно: p. V = const Изотермичен процес (T = const) В равнината (p, V) изотермичните процеси са представени при различни температури T чрез семейство хиперболи p ~ 1 / V, които се наричат изотерми. Уравнението на изотермичния процес е получено от експеримента на английския физик Р. Бойл (1662 г.) и независимо от френския физик Е. Мариот (1676 г.) Следователно уравнението се нарича закон на Бойл-Мариот. Т3 > Т2 > Т1
Изотермичен процес (T = const) В равнината (p, V) изотермичните процеси са представени при различни температури T чрез семейство хиперболи p ~ 1 / V, които се наричат изотерми. Уравнението на изотермичния процес е получено от експеримента на английския физик Р. Бойл (1662 г.) и независимо от френския физик Е. Мариот (1676 г.) Следователно уравнението се нарича закон на Бойл-Мариот. Т3 > Т2 > Т1 Изохоричен процес (V = const) Изохорният процес е процес на квазистатично нагряване или охлаждане на газ при постоянен обем V и при условие, че количеството вещество ν в съда остава непроменено. Както следва от уравнението на състоянието на идеалния газ, при тези условия налягането на газа p се променя пряко пропорционално на неговата абсолютна температура: p ~ T или = const
Изохоричен процес (V = const) Изохорният процес е процес на квазистатично нагряване или охлаждане на газ при постоянен обем V и при условие, че количеството вещество ν в съда остава непроменено. Както следва от уравнението на състоянието на идеалния газ, при тези условия налягането на газа p се променя пряко пропорционално на неговата абсолютна температура: p ~ T или = const Изохоричен процес (V = const) В равнината (p, T) изохоричните процеси за дадено количество материя ν за различни стойности на обем V са изобразени чрез семейство прави линии, наречени изохори. Големите стойности на обема съответстват на изохори с по-малък наклон по отношение на температурната ос (фиг.). Зависимостта на налягането на газа от температурата е изследвана експериментално от френския физик Ж. Чарлз (1787). Следователно уравнението на изохорния процес се нарича закон на Чарлз. V3 > V2 > V1
Изохоричен процес (V = const) В равнината (p, T) изохоричните процеси за дадено количество материя ν за различни стойности на обем V са изобразени чрез семейство прави линии, наречени изохори. Големите стойности на обема съответстват на изохори с по-малък наклон по отношение на температурната ос (фиг.). Зависимостта на налягането на газа от температурата е изследвана експериментално от френския физик Ж. Чарлз (1787). Следователно уравнението на изохорния процес се нарича закон на Чарлз. V3 > V2 > V1 Изобарен процес (p = const) Изобарният процес е квазистатичен процес, който протича при постоянно налягане p. Уравнението на изобарния процес за определено постоянно количество вещество ν има формата: където V 0 е обемът на газа при температура 0 °C. Коефициентът α е равен на (1/273, 15) K– 1. Неговият α се нарича температурен коефициент на обемно разширение на газовете.
Изобарен процес (p = const) Изобарният процес е квазистатичен процес, който протича при постоянно налягане p. Уравнението на изобарния процес за определено постоянно количество вещество ν има формата: където V 0 е обемът на газа при температура 0 °C. Коефициентът α е равен на (1/273, 15) K– 1. Неговият α се нарича температурен коефициент на обемно разширение на газовете.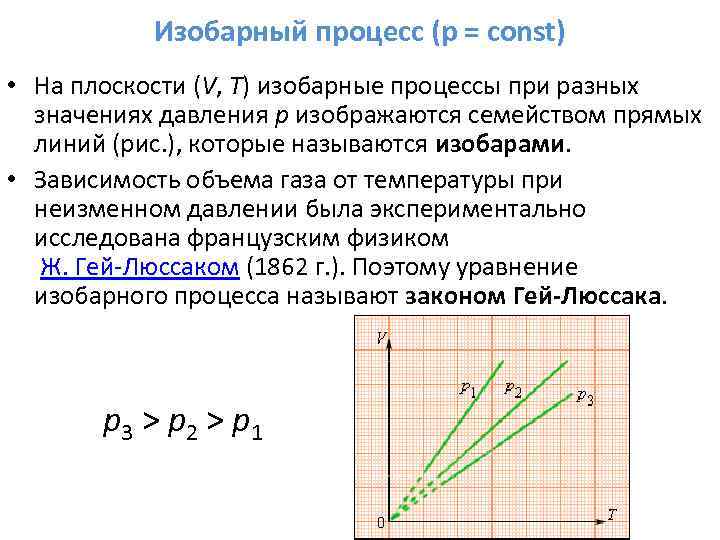 Изобарен процес (p = const) В равнината (V, T) изобарните процеси при различни стойности на налягането p са изобразени чрез семейство прави линии (фиг.), които се наричат изобари. Зависимостта на обема на газа от температурата при постоянно налягане е експериментално изследвана от френския физик J. Gay-Lussac (1862). Следователно уравнението на изобарния процес се нарича закон на Гей-Лусак. p3 > p2 > p1
Изобарен процес (p = const) В равнината (V, T) изобарните процеси при различни стойности на налягането p са изобразени чрез семейство прави линии (фиг.), които се наричат изобари. Зависимостта на обема на газа от температурата при постоянно налягане е експериментално изследвана от френския физик J. Gay-Lussac (1862). Следователно уравнението на изобарния процес се нарича закон на Гей-Лусак. p3 > p2 > p1 Изопроцеси Експериментално установените закони на Бойл-Мариот, Чарлз и Гей-Лусак намират обяснение на Мариот, Чарлз и Гей-Лусак в молекулярно-кинетичната теория на газовете. Те са следствие от уравнението на състоянието на идеалния газ.
Изопроцеси Експериментално установените закони на Бойл-Мариот, Чарлз и Гей-Лусак намират обяснение на Мариот, Чарлз и Гей-Лусак в молекулярно-кинетичната теория на газовете. Те са следствие от уравнението на състоянието на идеалния газ. Термодинамика Термодинамиката е наука за топлинните явления. За разлика от молекулярно-кинетичната теория, която прави заключения въз основа на идеи за
Термодинамика Термодинамиката е наука за топлинните явления. За разлика от молекулярно-кинетичната теория, която прави заключения въз основа на идеи за  Термодинамика Термодинамиката разглежда изолирани системи от тела, които са в състояние на термодинамично равновесие. Това означава, че всички наблюдавани макроскопични процеси са спрени в такива системи.
Термодинамика Термодинамиката разглежда изолирани системи от тела, които са в състояние на термодинамично равновесие. Това означава, че всички наблюдавани макроскопични процеси са спрени в такива системи. Термодинамика Ако една термодинамична система е била изложена на външно влияние, тя в крайна сметка ще премине в друго равновесно състояние. Такъв преход се нарича термодинамичен процес. Ако процесът протича достатъчно бавно (безкрайно бавно в границите), тогава системата във всеки момент от времето е близо до равновесното състояние. Процесите, състоящи се от последователност от равновесни състояния, се наричат квазистатични.
Термодинамика Ако една термодинамична система е била изложена на външно влияние, тя в крайна сметка ще премине в друго равновесно състояние. Такъв преход се нарича термодинамичен процес. Ако процесът протича достатъчно бавно (безкрайно бавно в границите), тогава системата във всеки момент от времето е близо до равновесното състояние. Процесите, състоящи се от последователност от равновесни състояния, се наричат квазистатични. Термодинамика. Вътрешна енергия Една от най-важните концепции на термодинамиката е вътрешната енергия на тялото. Всички макроскопични тела имат енергия, съдържаща се в самите тела. От гледна точка на MKT вътрешната енергия на веществото е сумата от кинетичната енергия на всички атоми и молекули и потенциалната енергия на тяхното взаимодействие помежду си. По-специално, вътрешната енергия на идеален газ е равна на сумата от кинетичните енергии на всички газови частици в непрекъснато и случайно топлинно движение. От това следва законът на Джаул, потвърден от множество експерименти: Вътрешната енергия на идеален газ зависи само от неговата температура и не зависи от обема
Термодинамика. Вътрешна енергия Една от най-важните концепции на термодинамиката е вътрешната енергия на тялото. Всички макроскопични тела имат енергия, съдържаща се в самите тела. От гледна точка на MKT вътрешната енергия на веществото е сумата от кинетичната енергия на всички атоми и молекули и потенциалната енергия на тяхното взаимодействие помежду си. По-специално, вътрешната енергия на идеален газ е равна на сумата от кинетичните енергии на всички газови частици в непрекъснато и случайно топлинно движение. От това следва законът на Джаул, потвърден от множество експерименти: Вътрешната енергия на идеален газ зависи само от неговата температура и не зависи от обема Термодинамика. Вътрешната енергия на MKT води до следния израз за вътрешната енергия на един мол идеален едноатомен газ (хелий, неон и др.), чиито молекули извършват само транслационно движение: Тъй като потенциалната енергия на взаимодействието на молекулите зависи от разстоянието между тях, в общия случай вътрешната енергия U на тялото зависи заедно с температурата T, зависи и от обема V: T U = U (T, V) Така вътрешната енергия U на тяло се определя еднозначно от макроскопичните параметри, характеризиращи състоянието на тялото. Не зависи от това как е реализирано даденото състояние. Прието е да се казва, че вътрешната енергия е държавна функция.
Термодинамика. Вътрешната енергия на MKT води до следния израз за вътрешната енергия на един мол идеален едноатомен газ (хелий, неон и др.), чиито молекули извършват само транслационно движение: Тъй като потенциалната енергия на взаимодействието на молекулите зависи от разстоянието между тях, в общия случай вътрешната енергия U на тялото зависи заедно с температурата T, зависи и от обема V: T U = U (T, V) Така вътрешната енергия U на тяло се определя еднозначно от макроскопичните параметри, характеризиращи състоянието на тялото. Не зависи от това как е реализирано даденото състояние. Прието е да се казва, че вътрешната енергия е държавна функция. Термодинамика. Начини за промяна на вътрешната енергия Вътрешната енергия на тялото може да се промени, ако външните сили, действащи върху него, работят (положително или отрицателно). работа Например, ако газът е компресиран в цилиндър под буталото, тогава външните сили извършват някаква положителна работа A "върху газа. В същото време силите на налягане, A", действащи върху буталото от газа, извършват работа A = -A "
Термодинамика. Начини за промяна на вътрешната енергия Вътрешната енергия на тялото може да се промени, ако външните сили, действащи върху него, работят (положително или отрицателно). работа Например, ако газът е компресиран в цилиндър под буталото, тогава външните сили извършват някаква положителна работа A "върху газа. В същото време силите на налягане, A", действащи върху буталото от газа, извършват работа A = -A " Термодинамика. Методи за промяна на вътрешната енергия Вътрешната енергия на тялото може да се промени не само в резултат на извършената работа, но и в резултат на пренос на топлина. При термичен контакт на телата вътрешната енергия на едно от тях може да се увеличи, а на другото да намалее. В този случай се говори за топлинен поток от едно тяло към друго. Количеството топлина Q, получено от тялото, Количеството топлина Q е промяната във вътрешната енергия на тялото в резултат на пренос на топлина.
Термодинамика. Методи за промяна на вътрешната енергия Вътрешната енергия на тялото може да се промени не само в резултат на извършената работа, но и в резултат на пренос на топлина. При термичен контакт на телата вътрешната енергия на едно от тях може да се увеличи, а на другото да намалее. В този случай се говори за топлинен поток от едно тяло към друго. Количеството топлина Q, получено от тялото, Количеството топлина Q е промяната във вътрешната енергия на тялото в резултат на пренос на топлина. Термодинамика. Начини за промяна на вътрешната енергия Прехвърлянето на енергия от едно тяло към друго под формата на топлина може да се случи само ако между тях има температурна разлика. Топлинният поток винаги е насочен от горещо тяло към студено.Количеството топлина Q е енергийна величина. В SI количеството топлина се измерва в единици за механична работа - джаули (J).
Термодинамика. Начини за промяна на вътрешната енергия Прехвърлянето на енергия от едно тяло към друго под формата на топлина може да се случи само ако между тях има температурна разлика. Топлинният поток винаги е насочен от горещо тяло към студено.Количеството топлина Q е енергийна величина. В SI количеството топлина се измерва в единици за механична работа - джаули (J). Термодинамика. Първият закон на термодинамиката условно са изобразени енергийните потоци между избраната термодинамична система и околните тела. Стойността на Q > 0, ако топлинният поток Q > 0 е насочен към термодинамичната система. Стойността A > 0, ако системата извършва положителна работа A > 0 върху околните тела. Ако системата обменя топлина с околните тела и извършва работа (положителна или отрицателна), тогава състоянието на системата се променя, състоянието на системата се променя, т.е. променят се нейните макроскопични параметри (температура, налягане, обем).
Термодинамика. Първият закон на термодинамиката условно са изобразени енергийните потоци между избраната термодинамична система и околните тела. Стойността на Q > 0, ако топлинният поток Q > 0 е насочен към термодинамичната система. Стойността A > 0, ако системата извършва положителна работа A > 0 върху околните тела. Ако системата обменя топлина с околните тела и извършва работа (положителна или отрицателна), тогава състоянието на системата се променя, състоянието на системата се променя, т.е. променят се нейните макроскопични параметри (температура, налягане, обем). Термодинамика. Първият закон на термодинамиката Тъй като вътрешната енергия U се определя еднозначно от макроскопични параметри, характеризиращи състоянието на системата, следва, че процесите на пренос на топлина и работа са придружени от промяна на вътрешната енергия на системата ΔU.
Термодинамика. Първият закон на термодинамиката Тъй като вътрешната енергия U се определя еднозначно от макроскопични параметри, характеризиращи състоянието на системата, следва, че процесите на пренос на топлина и работа са придружени от промяна на вътрешната енергия на системата ΔU. Термодинамика. Първият закон на термодинамиката Първият закон на термодинамиката е обобщение на закона за запазване и преобразуване на енергията за една термодинамична система. Формулира се по следния начин: Промяната ΔU на вътрешната енергия на неизолирана термодинамична система е равна на разликата между количеството топлина Q, предадено на системата, и работата А, извършена от системата върху външни тела. ΔU = Q - A Съотношението, изразяващо първия закон на термодинамиката, често се записва в различна форма: Q = ΔU + A Количеството топлина, получено от системата, отива за промяна на нейната вътрешна енергия и извършване на работа върху външни тела.
Термодинамика. Първият закон на термодинамиката Първият закон на термодинамиката е обобщение на закона за запазване и преобразуване на енергията за една термодинамична система. Формулира се по следния начин: Промяната ΔU на вътрешната енергия на неизолирана термодинамична система е равна на разликата между количеството топлина Q, предадено на системата, и работата А, извършена от системата върху външни тела. ΔU = Q - A Съотношението, изразяващо първия закон на термодинамиката, често се записва в различна форма: Q = ΔU + A Количеството топлина, получено от системата, отива за промяна на нейната вътрешна енергия и извършване на работа върху външни тела. Термодинамика. Първият закон на термодинамиката Нека приложим първия закон на термодинамиката към изопроцесите в газовете. При изохоричен процес (V = const) газът не върши работа, A = 0. Следователно Q = ΔU = U (T 2) - U (T 1). Тук U (T 1) и U (T 2) са вътрешните енергии на газа в началното и крайното състояние. Вътрешната енергия на идеален газ зависи само от температурата (закон на Джаул). По време на изохорно нагряване топлината се абсорбира от газа (Q > 0) и неговата вътрешна енергия се увеличава. По време на охлаждането топлината се отдава на външни тела (Q 0 - топлината се абсорбира от газа и газът извършва положителна работа. С изобарна компресия Q
Термодинамика. Първият закон на термодинамиката Нека приложим първия закон на термодинамиката към изопроцесите в газовете. При изохоричен процес (V = const) газът не върши работа, A = 0. Следователно Q = ΔU = U (T 2) - U (T 1). Тук U (T 1) и U (T 2) са вътрешните енергии на газа в началното и крайното състояние. Вътрешната енергия на идеален газ зависи само от температурата (закон на Джаул). По време на изохорно нагряване топлината се абсорбира от газа (Q > 0) и неговата вътрешна енергия се увеличава. По време на охлаждането топлината се отдава на външни тела (Q 0 - топлината се абсорбира от газа и газът извършва положителна работа. С изобарна компресия Q Термични двигатели. Термодинамични цикли. Цикъл на Карно Топлинният двигател е устройство, способно да преобразува полученото количество топлина в
Термични двигатели. Термодинамични цикли. Цикъл на Карно Топлинният двигател е устройство, способно да преобразува полученото количество топлина в  Термични двигатели. Термодинамични цикли. Цикъл на Карно
Термични двигатели. Термодинамични цикли. Цикъл на Карно  Термични двигатели. Термодинамични цикли. Цикъл на Карно Работата А, извършена от работния флуид за цикъл, е равна на количеството топлина Q, получено за цикъл.Съотношението на работата А към количеството топлина Q 1, получено от работния флуид за цикъл от нагревателя, се нарича ефективност η на топлинния двигател:
Термични двигатели. Термодинамични цикли. Цикъл на Карно Работата А, извършена от работния флуид за цикъл, е равна на количеството топлина Q, получено за цикъл.Съотношението на работата А към количеството топлина Q 1, получено от работния флуид за цикъл от нагревателя, се нарича ефективност η на топлинния двигател: Термични двигатели. Термодинамични цикли. Цикълът на Карно Коефициентът на полезно действие показва каква част от топлинната енергия, получена от работния флуид от "горещия" топлинен резервоар, се е превърнала в полезна работа. Останалото (1 - η) беше "безполезно" прехвърлено в хладилника. (1 – η) Ефективността на топлинния двигател винаги е по-малка от единица (η 0, A > 0, Q 2 T 2
Термични двигатели. Термодинамични цикли. Цикълът на Карно Коефициентът на полезно действие показва каква част от топлинната енергия, получена от работния флуид от "горещия" топлинен резервоар, се е превърнала в полезна работа. Останалото (1 - η) беше "безполезно" прехвърлено в хладилника. (1 – η) Ефективността на топлинния двигател винаги е по-малка от единица (η 0, A > 0, Q 2 T 2 Термични двигатели. Термодинамични цикли. Цикъл на Карно През 1824 г. френският инженер С. Карно разглежда кръгов процес, състоящ се от две изотерми и две адиабати, които играят важна роля в развитието на теорията на топлинните процеси. Нарича се цикъл на Карно (фиг. 3. 11. 4).
Термични двигатели. Термодинамични цикли. Цикъл на Карно През 1824 г. френският инженер С. Карно разглежда кръгов процес, състоящ се от две изотерми и две адиабати, които играят важна роля в развитието на теорията на топлинните процеси. Нарича се цикъл на Карно (фиг. 3. 11. 4). Термични двигатели. Термодинамични цикли. Цикъл на Карно Цикълът на Карно се осъществява от газа в цилиндъра под буталото. В изотермичната секция (1–2) газът се поставя в топлинен контакт с горещ термичен резервоар (нагревател) с температура T 1. Газът се разширява изотермично, извършвайки работа A 12, докато известно количество топлина Q 1 = Към газа се подава A 12. По-нататък в адиабатния участък (2–3) газът се поставя в адиабатна обвивка и продължава да се разширява при липса на пренос на топлина. В тази секция газът извършва работа A 23 > 0. Температурата на газа по време на адиабатно разширение пада до стойността T 2. В следващата изотермична секция (3–4) газът се поставя в топлинен контакт със студена термична резервоар (хладилник) при температура Т 2
Термични двигатели. Термодинамични цикли. Цикъл на Карно Цикълът на Карно се осъществява от газа в цилиндъра под буталото. В изотермичната секция (1–2) газът се поставя в топлинен контакт с горещ термичен резервоар (нагревател) с температура T 1. Газът се разширява изотермично, извършвайки работа A 12, докато известно количество топлина Q 1 = Към газа се подава A 12. По-нататък в адиабатния участък (2–3) газът се поставя в адиабатна обвивка и продължава да се разширява при липса на пренос на топлина. В тази секция газът извършва работа A 23 > 0. Температурата на газа по време на адиабатно разширение пада до стойността T 2. В следващата изотермична секция (3–4) газът се поставя в топлинен контакт със студена термична резервоар (хладилник) при температура Т 2 Необратимостта на топлинните процеси. Вторият закон на термодинамиката. Първият закон на термодинамиката - законът за запазване на енергията за топлинни процеси - установява връзка между количеството топлина Q, получено от системата, промяната ΔU на нейната вътрешна енергия и работата A, извършена върху външни тела: Q = ΔU + A Съгласно този закон енергията не може да бъде създадена или унищожена; тя се пренася от една система в друга и се трансформира от една форма в друга. Никога не са наблюдавани процеси, които нарушават първия закон на термодинамиката. На фиг. показани са устройства, забранени от първия закон на термодинамиката Циклично работещи топлинни двигатели, забранени от първия закон на термодинамиката: 1 - вечен двигател от 1-ви вид, извършващ работа без изразходване на енергия отвън; 2 - топлинен двигател с ефективност η > 1
Необратимостта на топлинните процеси. Вторият закон на термодинамиката. Първият закон на термодинамиката - законът за запазване на енергията за топлинни процеси - установява връзка между количеството топлина Q, получено от системата, промяната ΔU на нейната вътрешна енергия и работата A, извършена върху външни тела: Q = ΔU + A Съгласно този закон енергията не може да бъде създадена или унищожена; тя се пренася от една система в друга и се трансформира от една форма в друга. Никога не са наблюдавани процеси, които нарушават първия закон на термодинамиката. На фиг. показани са устройства, забранени от първия закон на термодинамиката Циклично работещи топлинни двигатели, забранени от първия закон на термодинамиката: 1 - вечен двигател от 1-ви вид, извършващ работа без изразходване на енергия отвън; 2 - топлинен двигател с ефективност η > 1 Необратимостта на топлинните процеси. Вторият закон на термодинамиката. Първият закон на термодинамиката не установява посоката на топлинните процеси Първият закон на термодинамиката процеси. Въпреки това, както показва опитът, много топлинни процеси могат да протичат само в една посока. Такива процеси се наричат необратими. Например при термичен контакт на две тела с различна температура топлинният поток винаги е насочен от по-топло тяло към по-студено. Никога не се наблюдава спонтанен процес на пренос на топлина от тяло с ниска температура към тяло с по-висока температура. Следователно процесът на пренос на топлина при крайна температурна разлика е необратим. Обратимите процеси са процеси на преход на система от едно равновесно състояние в друго, които могат да се осъществят в обратна посока чрез същата последователност от междинни равновесни състояния. В този случай самата система и околните тела се връщат в първоначалното си състояние. Процесите, при които системата винаги остава в състояние на равновесие, се наричат квазистатични. Всички квазистатични процеси са обратими. Всички обратими процеси са квазистатични.
Необратимостта на топлинните процеси. Вторият закон на термодинамиката. Първият закон на термодинамиката не установява посоката на топлинните процеси Първият закон на термодинамиката процеси. Въпреки това, както показва опитът, много топлинни процеси могат да протичат само в една посока. Такива процеси се наричат необратими. Например при термичен контакт на две тела с различна температура топлинният поток винаги е насочен от по-топло тяло към по-студено. Никога не се наблюдава спонтанен процес на пренос на топлина от тяло с ниска температура към тяло с по-висока температура. Следователно процесът на пренос на топлина при крайна температурна разлика е необратим. Обратимите процеси са процеси на преход на система от едно равновесно състояние в друго, които могат да се осъществят в обратна посока чрез същата последователност от междинни равновесни състояния. В този случай самата система и околните тела се връщат в първоначалното си състояние. Процесите, при които системата винаги остава в състояние на равновесие, се наричат квазистатични. Всички квазистатични процеси са обратими. Всички обратими процеси са квазистатични. Необратимостта на топлинните процеси. Вторият закон на термодинамиката. Процесите на преобразуване на механичната работа във вътрешна енергия на тялото са необратими поради наличието на триене, дифузионни процеси в газове и течности, процеси на смесване на газове при наличие на първоначална разлика в налягането и др. Всички реални процеси са необратими, но те може да се доближи до обратими произволно близки процеси. Обратимите процеси са идеализация на реални процеси. Първият закон на термодинамиката не може да разграничи обратимите от необратимите процеси. Той просто изисква определен енергиен баланс от термодинамичния процес и не казва нищо за това дали такъв процес е възможен или не.
Необратимостта на топлинните процеси. Вторият закон на термодинамиката. Процесите на преобразуване на механичната работа във вътрешна енергия на тялото са необратими поради наличието на триене, дифузионни процеси в газове и течности, процеси на смесване на газове при наличие на първоначална разлика в налягането и др. Всички реални процеси са необратими, но те може да се доближи до обратими произволно близки процеси. Обратимите процеси са идеализация на реални процеси. Първият закон на термодинамиката не може да разграничи обратимите от необратимите процеси. Той просто изисква определен енергиен баланс от термодинамичния процес и не казва нищо за това дали такъв процес е възможен или не. Необратимостта на топлинните процеси. Вторият закон на термодинамиката. Посоката на спонтанно протичащите процеси установява втория закон на термодинамиката. Може да се формулира в термодинамиката като забрана на определени видове термодинамични процеси. Английският физик У. Келвин дава следната формулировка на втория закон през 1851 г.: вторият закон В циклично работеща топлинна машина е невъзможен процес, чийто единствен резултат би бил превръщането в механична работа на цялото количество топлина получена от един топлинен резервоар.
Необратимостта на топлинните процеси. Вторият закон на термодинамиката. Посоката на спонтанно протичащите процеси установява втория закон на термодинамиката. Може да се формулира в термодинамиката като забрана на определени видове термодинамични процеси. Английският физик У. Келвин дава следната формулировка на втория закон през 1851 г.: вторият закон В циклично работеща топлинна машина е невъзможен процес, чийто единствен резултат би бил превръщането в механична работа на цялото количество топлина получена от един топлинен резервоар. Необратимостта на топлинните процеси. Вторият закон на термодинамиката. Немският физик Р. Клаузиус дава различна формулировка на втория закон на термодинамиката: Невъзможен е процес, чийто единствен резултат би бил преносът на енергия чрез пренос на топлина от тяло с ниска температура към тяло с по-висока температура . На фиг. изобразени са процесите, забранени от втория закон, но незабранени от първия закон на термодинамиката. Тези процеси съответстват на две формулировки на втория закон на термодинамиката. 1 - вечен двигател от втори вид; 2 - спонтанен пренос на топлина от студено тяло към по-топло (идеален хладилник)
Необратимостта на топлинните процеси. Вторият закон на термодинамиката. Немският физик Р. Клаузиус дава различна формулировка на втория закон на термодинамиката: Невъзможен е процес, чийто единствен резултат би бил преносът на енергия чрез пренос на топлина от тяло с ниска температура към тяло с по-висока температура . На фиг. изобразени са процесите, забранени от втория закон, но незабранени от първия закон на термодинамиката. Тези процеси съответстват на две формулировки на втория закон на термодинамиката. 1 - вечен двигател от втори вид; 2 - спонтанен пренос на топлина от студено тяло към по-топло (идеален хладилник)