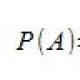Sitenin bölümleri
Editörün Seçimi:
- Pazar Okulu Mezuniyet (Toosh) Pazar Okulu Mezuniyet Belgesi
- Kutsal doktor-şehit Eugene Botkin
- Tutkulu Evgeny Botkin
- Kaygı, korku ve endişeden nasıl kurtulurum
- Erkek psikolojisinde "Napolyon kompleksi" Napolyon sendromu nedir
- Evgeny botkin
- Kadın sesi: sınıflandırma, en düşük ve en yüksek kadın sesi
- Aydınlanma (uyanış) deneyiminden sonra yaşam nasıl değişir?
- Testin ana noktaları
- Ölüm korkusundan nasıl kurtulur: tavsiye ve psikoterapötik yardım
reklam
| Erken teslimat için kimya seçeneklerinde Ege. Ek malzeme ve ekipman |
|
Cevaplar ve çözüm - kimya 2017 için erken bir seçenek 1-3 arası görevler için aşağıdaki kimyasal element sırasını kullanın. 1-3 görevlerindeki cevap, altındaki kimyasal elementlerin altında bir sayı dizisidir. Bu diziler... 1) S 2) Na 3) Al 4) Si 5) Mg 1) Seride belirtilen elementlerin hangi atomlarının temel durumda eşleşmemiş bir elektron içerdiğini belirleyin. Cevap alanına seçilen öğelerin numaralarını yazın Bu elemanların elektronik konfigürasyonlarını yazalım. D: 1s 2 2s 2 2p 6 3s 2 3p 4 Na: 1s 2 2s 2 2p 6 3s 1 Al: s 2 2s 2 2p 6 3s 2 3p 1 Si: 1s 2 2s 2 2p 6 3s 2 3p 2 Yg: 1s 2 2s 2 2p 6 3s 2 Na ve Al elementlerinin her birinin eşlenmemiş bir elektronu olduğunu görüyoruz. Verilen dönüşüm şemasında XY Cu CuCl CuI ⎯⎯ → ⎯⎯ 2 → X ve Y maddeleri şunlardır: 1) AgI 2) I2 3) Cl2 4) HCl 5) KI Seçilen maddelerin numaralarını aşağıdaki tabloya yazın. karşılık gelen harfler 2 ) Listelenen kimyasal elementlerden üç metal element seçin. Seçili öğeleri artan onarıcı özellikler sırasına göre düzenleyin. Cevap alanına seçilen öğelerin numaralarını istediğiniz sırayla yazın İndirgeme özellikleri gruplarda sağdan sola ve periyotlarda yukarıdan aşağıya artar, bu nedenle üç element - Na, Mg, Al metalleri, Al, Mg, Na'yı düzenleyeceğiz. 3) Sırada belirtilen elementler arasından oksijenle birleştiğinde +4 oksidasyon durumu sergileyen iki element seçin. Cevap alanına seçilen öğelerin numaralarını yazın. oksijen ile olası bileşikleri yazın 4) Önerilen maddeler listesinden, iyonik olan iki madde seçin. Kimyasal bağ. 1) KCl 2) KNO3 3) H3BO3 4) H2SO4 5) PCl3 5) Bir maddenin formülü ile bu maddenin ait olduğu sınıf / grup arasında bir yazışma kurun: bir harfle gösterilen her pozisyon için bir sayı ile gösterilen ilgili pozisyonu seçin. 6) Önerilen maddeler listesinden, çinkonun her biri ile etkileşime girdiği iki madde seçin. 1) nitrik asit (çözelti) 2) demir (II) hidroksit 3) magnezyum sülfat (çözelti) 4) sodyum hidroksit (çözelti) 5) alüminyum klorür (çözelti) 3Zn + 8HNO3 = 3Zn (NO3) 2 + 4H2O + 2NO Zn + 2NaOH + 2H2O = Na2 + H2 7 ) Önerilen maddeler listesinden suyla reaksiyona giren iki oksit seçin. Cevap alanına seçilen maddelerin numaralarını yazın. BaO + H2O = Ba (OH) 2 8) Bir test tüpüne bir X tuzu çözeltisi ile bir Y maddesi çözeltisi ilave edildi. Reaksiyon sonucunda beyaz bir çökelti oluşumu gözlendi. Önerilen maddeler listesinden, açıklanan reaksiyona girebilecek X ve Y maddelerini seçin. 1) hidrojen bromür 3) sodyum nitrat 4) kükürt (IV) oksit 5) alüminyum klorür Tabloda seçilen sayıları ilgili harflerin altına yazın. AlCl3 + 3NH4OH = Al (OH) 3+ 3NH4Cl NH3 -> NH3 * H2O maddesinin çözeltisi 9) Belirli bir dönüşüm şemasında Cu — X—- CuCl2 — Y—— CuI X ve Y maddeleri şunlardır: Tabloda seçilen maddelerin numaralarını uygun harflerin altına yazınız. 2CuCl2 + 4KI = 2CuI + I2 + 2KCl 10) Reaksiyon denklemi ve arasında bir yazışma oluşturun oksitleyici ajan bu reaksiyonda: bir harfle gösterilen her bir pozisyon için, bir sayı ile gösterilen ilgili pozisyonu seçin.
Cevap: 1433 11) 1215 30) KI + KIO 3 + H 2 SO 4 = I 2 + K 2 SO 4 + H 2 O
I-1 indirgeyici ajan nedeniyle KI I +5 oksitleyici nedeniyle KIO 3 5KI + KIO 3 + 3H 2 SO 4 = 3I 2 + 3K 2 SO 4 + 3H 2 O 1) 2Cu (NO 3) 2- → 2CuO + 4NO 2 + O 2 Kimyada KULLANIM'ın sonucu, belirlenen minimum puan sayısından daha az olmamak üzere, listede yer alan uzmanlık alanlarındaki üniversitelere kayıt olma hakkı verir. giriş sınavları kimya dersi var Üniversitelerin kurulmasına izin verilmiyor minimum eşik kimyada 36 puanın altında. Prestijli üniversiteler minimum eşiklerini çok daha yükseğe koyma eğilimindedirler. Çünkü birinci sınıf öğrencilerinin orada okumak için çok iyi bilgiye sahip olmaları gerekir. FIPI'nin resmi web sitesi, her yıl Kimyada Birleşik Devlet Sınavının sürümlerini yayınlar: gösteri, erken periyot... Gelecekteki sınavın yapısı ve görevlerin karmaşıklık düzeyi hakkında fikir veren ve sınava hazırlanırken güvenilir bilgi kaynakları olan bu seçeneklerdir. 2017 kimya sınavının erken versiyonu
FIPI'den kimya 2017 sınavının gösteri versiyonu
V sınav çeşitleri 2017'de kimyada, son 2016'nın CMM'sine kıyasla değişiklikler var, bu nedenle mevcut sürüme göre eğitim yapılması ve mezunların çeşitli gelişimi için önceki yılların seçeneklerinin kullanılması tavsiye edilir. Ek malzeme ve ekipman Sınavın her seçeneği için sınav çalışması kimyada aşağıdaki malzemeler eklenmiştir: − periyodik sistem kimyasal elementler D.I. Mendeleyev; - sudaki tuzların, asitlerin ve bazların çözünürlük tablosu; - metal voltajlarının elektrokimyasal serisi. İşlem esnasında sınav çalışması programlanamayan bir hesap makinesinin kullanılmasına izin verilir. Birleşik Devlet Sınavı için kullanımına izin verilen ek cihaz ve malzemelerin listesi, Rusya Eğitim ve Bilim Bakanlığı'nın emriyle onaylanmıştır. Bir üniversitede eğitimine devam etmek isteyenler için konu seçimi, seçilen uzmanlık alanındaki giriş sınavlarının listesine bağlı olmalıdır. Tüm uzmanlıklar (eğitim alanları) için üniversitelere giriş sınavlarının listesi, Rusya Eğitim ve Bilim Bakanlığı'nın emriyle belirlenir. Her üniversite, kabul kurallarında belirttiği belirli konuları bu listeden seçer. Birleşik Devlet Sınavı'na seçilen derslerin bir listesiyle katılmak için başvurmadan önce, seçilen üniversitelerin web sitelerinde bu bilgilere aşina olmanız gerekir. 8.3 g ağırlığındaki sodyum nitrür, %20 kütle fraksiyonu ve 490 g kütle ile sülfürik asit ile reaksiyona girdi Daha sonra elde edilen solüsyona 57.2 g ağırlığında kristal soda ilave edildi Nihai solüsyondaki asidin kütle fraksiyonunu (%) bulun. Problem durumunda belirtilen reaksiyon denklemlerini yazın, gerekli tüm hesaplamaları getirin (istenen fiziksel büyüklüklerin ölçüm birimlerini belirtin). Sitenin cevabını en yakın tam sayıya yuvarlayın.
Gerçek sınav 2017. Görev 34.Döngüsel A maddesi (oksijen ve ikame içermez), döngünün bir kopması ile 20.8 g ağırlığındaki B maddesine oksitlenir, yanma ürünleri 13.44 litre hacimli karbondioksit ve 7.2 g ağırlığında sudur. görev koşulları: 1) organik madde B'nin moleküler formülünü oluşturmak için gerekli hesaplamaları yapmak; 2) A ve B organik maddelerinin moleküler formüllerini yazın; 3) moleküldeki atom bağlarının sırasını açık bir şekilde yansıtan A ve B organik maddelerinin yapısal formüllerini oluşturur; 4) B maddesini oluşturmak için A maddesinin potasyum permanganat sülfat çözeltisi ile oksidasyon reaksiyonunun denklemini yazın. Sitenin cevabında, orijinal A organik maddesinin bir molekülündeki tüm atomların toplamını belirtin.
Kimya 2017'de erken sınav. Görev 31Gümüş (I) nitratın kalsinasyonundan elde edilen gaz, potasyum kloratın dekompozisyonundan elde edilen başka bir gaz ile karıştırılmıştır. Ortaya çıkan gaz karışımı, bir asit oluşturmak üzere su içinde yutuldu. Magnezyum fosfit hidroklorik asit ile işlendi ve gaz çıktı. Bu gaz, elde edilen asidin sıcak, konsantre bir çözeltisinden dikkatlice geçirildi. Tanımlanan beş reaksiyon için denklemleri yazın. Cevapta, tüm denklemlerdeki katsayıların toplamını belirtin.
2017 kimya erken sınavı. Görev 3345 g ağırlığındaki potasyum bikarbonat, sabit ağırlığa kadar kalsine edildi. Tortu, fazla sülfürik asit içinde çözüldü. Nihai gaz, 200 g %5.6'lık bir potasyum hidroksit çözeltisinden geçirildi. Oluşan tuzun bileşimini ve kütlesini, çözeltideki kütle fraksiyonunu (%) belirleyin. Çözerken, problem durumunda belirtilen reaksiyon denklemlerini yazın ve gerekli tüm hesaplamaları yapın (istenen fiziksel büyüklüklerin ölçüm birimlerini belirtin). Cevapta, oluşan tuzun mol kütlesinin (g / mol) toplamını, kütlesini (g) ve kütle fraksiyonunu (%, tam sayıya yuvarlayarak) son çözeltiye yazın. Gazların sudaki çözünürlüğünü dikkate almayın.
Kimya 2017'de erken sınav. Görev 3412.24 g siklik olmayan bir yapıya sahip organik maddenin yanması sırasında, 20.16 l (n.u.) karbon dioksit ve 12.96 g su elde edildi. Bu organik maddenin 1 molünün sadece 1 mol su eklediği ve bu maddenin amonyak gümüş oksit çözeltisi ile reaksiyona girmediği bilinmektedir. Problemin verilen koşullarına göre: 1) Organik maddenin moleküler formülünü oluşturmak için gerekli hesaplamaları yapar. 2) organik maddenin moleküler formülünü oluşturur. 3) molekülündeki atomların bağlarının sırasını açık bir şekilde yansıtan organik maddenin yapısal formülünü oluşturur. 4) Organik maddenin hidrasyon reaksiyonunun denklemini yapar. Cevapta şunu yazın molar kütle(g/mol) orijinal organik madde.
1-3 arası görevler için aşağıdaki kimyasal element sırasını kullanın. 1-3 görevlerindeki cevap, altında bu satırdaki kimyasal elementlerin gösterildiği bir sayı dizisidir.
Görev numarası 1 Seride belirtilen elementlerin hangi atomlarının temel durumda eşleşmemiş bir elektron içerdiğini belirleyin. Cevap: 23 Açıklama: Belirtilen kimyasal elementlerin her biri için elektronik formülü yazalım ve son elektronik seviyenin elektron grafik formülünü gösterelim: 1) S: 1s 2 2s 2 2p 6 3s 2 3p 4 2) Na: 1s 2 2s 2 2p 6 3s 1 3) Al: 1s 2 2s 2 2p 6 3s 2 3p 1 4) Si: 1s 2 2s 2 2p 6 3s 2 3p 2 5) Mg: 1s 2 2s 2 2p 6 3s 2 Görev numarası 2 Listelenen kimyasal elementlerden üç metal element seçin. Seçili öğeleri artan onarıcı özellikler sırasına göre düzenleyin. Cevap alanına, seçilen öğelerin numaralarını gerekli sırayla yazın. Cevap: 352 Açıklama: Periyodik tablonun ana alt gruplarında metaller, bor-astatin diyagonalinin yanı sıra yan alt gruplarda bulunur. Bu nedenle, belirtilen listedeki metaller Na, Al ve Mg'yi içerir. Periyot boyunca sola ve alt grup boyunca aşağı doğru hareket edildiğinde elementlerin metalik ve dolayısıyla indirgeme özellikleri artar. Böylece yukarıda sıralanan metallerin metalik özellikleri Al, Mg, Na serilerinde artar. Görev numarası 3 Sırada belirtilen elementler arasından oksijenle birleştiğinde +4 oksidasyon durumu sergileyen iki element seçin. Cevap alanına seçilen öğelerin numaralarını yazın. Cevap: 14 Açıklama: Sunulan listedeki elementlerin ana oksidasyon durumları karmaşık maddeler: Kükürt - "-2", "+4" ve "+6" Sodyum Na - "+1" (tek) Alüminyum Al - "+3" (tek) Silikon Si - "-4", "+4" Magnezyum Mg - "+2" (tek) Görev numarası 4 Önerilen maddeler listesinden, içinde iyonik bir kimyasal bağ bulunan iki madde seçin.
Cevap: 12 Açıklama: Çoğu durumda, bir bileşikte iyonik tipte bir bağın varlığı, yapısal birimlerinin aynı anda tipik bir metal atomlarını ve bir metal olmayan atomları içermesi gerçeğiyle belirlenebilir. Bu kritere göre iyonik bağ türü KCl ve KNO3 bileşiklerinde gerçekleşir. Yukarıdaki işarete ek olarak, yapısal biriminin bir amonyum katyonu (NH 4 +) veya organik analogları - alkilamonyum katyonları RNH 3 +, dialkilamonyum R2 NH2 + içermesi durumunda, bir bileşikte bir iyonik bağın varlığı söylenebilir. trialkilamonyum R3NH+ ve tetraalkilamonyum R4N+, burada R bir hidrokarbon radikalidir. Örneğin, iyonik tip bağ, (CH3)4 NCI bileşiğinde (CH3)4+ katyonu ile klorür iyonu Cl- arasında gerçekleşir. Görev numarası 5 Bir maddenin formülü ile bu maddenin ait olduğu sınıf / grup arasında bir yazışma kurun: bir harfle gösterilen her pozisyon için bir sayı ile gösterilen ilgili pozisyonu seçin.
Cevap: 241 Açıklama: N 2 O 3 metal olmayan bir oksittir. N 2 O, NO, SiO ve CO hariç tüm metal olmayan oksitler asidiktir. Al 2 O 3, oksidasyon durumunda +3 olan bir metal oksittir. + 3, + 4 oksidasyon durumundaki metal oksitlerin yanı sıra BeO, ZnO, SnO ve PbO amfoteriktir. HClO4, asitlerin tipik bir temsilcisidir, çünkü sulu bir çözeltide ayrışma üzerine, katyonlardan sadece H + katyonları oluşur: HClO 4 = H + + ClO 4 - Görev numarası 6 Önerilen maddeler listesinden, çinkonun her biri ile etkileşime girdiği iki madde seçin. 1) nitrik asit (çözelti) 2) demir (II) hidroksit 3) magnezyum sülfat (çözelti) 4) sodyum hidroksit (çözelti) 5) alüminyum klorür (çözelti) Cevap alanına seçilen maddelerin numaralarını yazın. Cevap: 14 Açıklama: 1) Nitrik asit güçlü bir oksitleyici ajandır ve platin ve altın hariç tüm metallerle reaksiyona girer. 2) Demir hidroksit (II) çözünmeyen bir bazdır. Metaller, çözünmeyen hidroksitlerle hiç reaksiyona girmez ve yalnızca üç metal çözünür (alkaliler) - Be, Zn, Al ile reaksiyona girer. 3) Magnezyum sülfat, çinkodan daha aktif bir metalin tuzudur ve bu nedenle reaksiyon ilerlemez. 4) Sodyum hidroksit - alkali ( çözünür hidroksit metal). Sadece Be, Zn, Al metal alkalilerle çalışır. 5) AlCl3, çinkodan daha aktif bir metalin tuzudur, yani. reaksiyon imkansızdır. Görev numarası 7 Önerilen maddeler listesinden suyla reaksiyona giren iki oksit seçin.
Cevap alanına seçilen maddelerin numaralarını yazın. Cevap: 14 Açıklama: Oksitlerden yalnızca alkali ve toprak alkali metallerin oksitleri su ile reaksiyona girer ve tüm asit oksitler SiO2 hariç. Bu nedenle, cevap seçenekleri 1 ve 4 uygundur: BaO + H20 = Ba (OH) 2 SO 3 + H 2 O = H 2 SO 4 Görev numarası 8 1) hidrojen bromür 3) sodyum nitrat 4) kükürt (IV) oksit 5) alüminyum klorür Tabloda seçilen sayıları ilgili harflerin altına yazın. Cevap: 52 Açıklama: Bu maddeler arasında tuzlar sadece sodyum nitrat ve alüminyum klorürdür. Sodyum tuzları gibi tüm nitratlar çözünürdür ve bu nedenle sodyum nitrat çökeltisi prensipte herhangi bir reaktif ile üretilemez. Bu nedenle, X tuzu yalnızca alüminyum klorür olabilir. Kimyada sınavı geçenler arasında yaygın bir hata, sulu bir çözeltide amonyağın reaksiyonun seyri nedeniyle zayıf bir baz - amonyum hidroksit oluşturduğunu anlamamaktır: NH3 + H2O<=>NH40H Bu bağlamda, sulu bir amonyak çözeltisi, çözünmeyen hidroksitler oluşturan metal tuzlarının çözeltileri ile karıştırıldığında bir çökelti verir: 3NH 3 + 3H20 + AlCl 3 = Al (OH) 3 + 3NH 4 Cl görev numarası 9 Belirli bir dönüşüm şemasında Cu x> CuCl2 Y> CuI X ve Y maddeleri şunlardır:
Cevap: 35 Açıklama: Bakır, etkinlik satırında hidrojenin sağında yer alan bir metaldir, yani. asitlerle reaksiyona girmez (H2S04 (kons.) ve HNO 3 hariç). Bu nedenle, bizim durumumuzda bakır klorür (ll) oluşumu yalnızca klor ile reaksiyona girdiğinde mümkündür: Cu + Cl 2 = CuCl 2 İyodür iyonları (I -) iki değerli bakır iyonlarıyla aynı çözeltide bir arada bulunamaz, çünkü onlar tarafından oksitlenir: Cu 2+ + 3I - = CuI + I 2 Görev numarası 10 Bu reaksiyonda reaksiyon denklemi ile oksitleyici madde arasında bir yazışma kurun: bir harfle gösterilen her pozisyon için bir sayı ile gösterilen ilgili pozisyonu seçin. Cevap: 1433 Açıklama: Reaksiyondaki oksitleyici ajan, oksidasyon durumunu düşüren bir element içeren maddedir. Görev numarası 11 Maddenin formülü ile bu maddenin etkileşime girebileceği reaktifler arasında bir yazışma kurun: bir harfle gösterilen her pozisyon için bir sayı ile gösterilen ilgili pozisyonu seçin. Cevap: 1215 Açıklama: A) Cu (NO 3) 2 + NaOH ve Cu (NO 3) 2 + Ba (OH) 2 - benzer etkileşimler. Başlangıç malzemeleri çözünürse ve ürünler bir çökelti, gaz veya düşük oranda ayrışan bir madde içeriyorsa, tuz metal hidroksitle reaksiyona girer. Hem birinci hem de ikinci reaksiyon için her iki gereklilik de karşılanmıştır: Cu (NO 3) 2 + 2NaOH = 2NaNO 3 + Cu (OH) 2 ↓ Cu (NO 3) 2 + Ba (OH) 2 = Na (NO 3) 2 + Cu (OH) 2 ↓ Cu (NO 3) 2 + Mg - serbest metal, tuzun bir parçası olandan daha aktifse, tuz bir metalle reaksiyona girer. Aktivite sırasındaki magnezyum, bakırın solunda bulunur, bu da daha büyük aktivitesini gösterir, bu nedenle reaksiyon ilerler: Cu (NO 3) 2 + Mg = Mg (NO 3) 2 + Cu B) Al (OH) 3 - +3 oksidasyon durumunda metal hidroksit. + 3, + 4 oksidasyon durumundaki metal hidroksitlerin yanı sıra istisnalar olarak Be (OH) 2 ve Zn (OH) 2 hidroksitleri amfoteriktir. Tanım olarak, amfoterik hidroksitler, alkaliler ve hemen hemen tüm çözünür asitlerle reaksiyona girenlerdir. Bu nedenle, cevap seçeneğinin hemen uygun olduğu sonucuna varabiliriz: Al (OH) 3 + 3HCl = AlCl 3 + 3H20 Al (OH) 3 + LiOH (çözelti) = Li veya Al (OH) 3 + LiOH (tv) = To => LiAlO 2 + 2H 2 O 2Al (OH) 3 + 3H 2 SO 4 = Al 2 (SO 4) 3 + 6H 2 O C) ZnCl 2 + NaOH ve ZnCl 2 + Ba (OH) 2 - "tuz + metal hidroksit" tipinin etkileşimi. A şıkkında açıklama yapılmıştır. ZnCl 2 + 2NaOH = Zn (OH) 2 + 2NaCl ZnCl 2 + Ba (OH) 2 = Zn (OH) 2 + BaCl 2 Aşırı NaOH ve Ba (OH) 2 ile not edilmelidir: ZnCl 2 + 4NaOH = Na 2 + 2NaCl ZnCl 2 + 2Ba (OH) 2 = Ba + BaCl 2 D) Br 2, O 2 güçlü oksidanlardır. Metallerden sadece gümüş, platin, altın ile reaksiyona girmezler: Cu + Br 2 t ° > CuBr2 2Cu + O2 t ° > 2CuO HNO 3, güçlü oksitleyici özelliklere sahip bir asittir, çünkü hidrojen katyonları ile değil, asit oluşturan bir element - nitrojen N +5 ile oksitlenir. Platin ve altın hariç tüm metallerle reaksiyona girer: 4HNO 3 (kons.) + Cu = Cu (NO 3) 2 + 2NO 2 + 2H 2 O 8HNO 3 (dil.) + 3Cu = 3Cu (NO 3) 2 + 2NO + 4H 2 O Görev numarası 12 Genel bir formül arasında bir yazışma kurun homolog seri ve bu seriye ait bir maddenin adı: bir harfle gösterilen her bir pozisyon için, bir sayı ile gösterilen ilgili pozisyonu seçin. Tabloda seçilen sayıları ilgili harflerin altına yazın.
Cevap: 231 Açıklama: Görev numarası 13 Önerilen maddeler listesinden, siklopentan izomerleri olan iki madde seçin. 1) 2-metilbütan 2) 1,2-dimetilsiklopropan 3) penten-2 4) heksen-2 5) siklopenten Cevap alanına seçilen maddelerin numaralarını yazın. Cevap: 23 Açıklama: Siklopentan, C5H10 moleküler formülüne sahiptir. Durumda listelenen maddelerin yapısal ve moleküler formüllerini yazalım.
Görev numarası 14 Önerilen maddeler listesinden, her biri bir potasyum permanganat çözeltisi ile reaksiyona giren iki madde seçin. 1) metilbenzen 2) sikloheksan 3) metilpropan Cevap alanına seçilen maddelerin numaralarını yazın. Cevap: 15 Açıklama: Hidrokarbonlardan, yapısal formüllerinde C = C veya C≡C bağları içerenlerin yanı sıra benzen homologları (benzenin kendisi hariç) sulu bir potasyum permanganat çözeltisi ile reaksiyona girer. Bu nedenle metilbenzen ve stiren uygundur. Görev numarası 15 Önerilen maddeler listesinden, fenolün etkileştiği iki madde seçin. 1) hidroklorik asit 2) sodyum hidroksit 4) nitrik asit 5) sodyum sülfat Cevap alanına seçilen maddelerin numaralarını yazın. Cevap: 24 Açıklama: Fenol, alkollerden daha belirgin olan hafif asidik özelliklere sahiptir. Bu nedenle fenoller, alkollerden farklı olarak alkalilerle reaksiyona girer: C6H5OH + NaOH = C6H5ONa + H20 Fenol, molekülünde doğrudan benzen halkasına bağlı bir hidroksil grubu içerir. Hidroksi grubu birinci türden bir yönlendiricidir, yani orto ve para pozisyonlarında ikame reaksiyonlarını kolaylaştırır: Görev numarası 16 Önerilen maddeler listesinden hidrolize uğrayan iki madde seçin. 1) glikoz 2) sakaroz 3) fruktoz 5) nişasta Cevap alanına seçilen maddelerin numaralarını yazın. Cevap: 25 Açıklama: Bu maddelerin tamamı karbonhidrattır. Karbonhidratlardan monosakkaritler hidrolize uğramazlar. Glikoz, fruktoz ve riboz monosakkarit, sakaroz disakkarit ve nişasta polisakkarittir. Sonuç olarak, belirtilen listedeki sakaroz ve nişasta hidrolize uğrar. Görev numarası 17 Aşağıdaki maddelerin dönüşüm şeması verilmiştir: 1,2-dibromoetan → X → bromoetan → Y → etil format Belirtilen maddelerden hangilerinin X ve Y maddeleri olduğunu belirleyin. 2) etanal 4) kloroetan 5) asetilen Tabloda seçilen maddelerin numaralarını uygun harflerin altına yazınız. Görev numarası 18 Başlangıç maddesinin adı ile ağırlıklı olarak bu madde brom ile etkileşime girdiğinde oluşan ürün arasında bir yazışma kurun: bir harfle gösterilen her bir pozisyon için bir sayı ile gösterilen ilgili pozisyonu seçin. Tabloda seçilen sayıları ilgili harflerin altına yazın.
Cevap: 2134 Açıklama: İkincil karbon atomunda yer değiştirme, birincil karbon atomundan daha büyük ölçüde gerçekleşir. Bu nedenle propan bromlamanın ana ürünü 1-bromopropan değil 2-bromopropandır: Sikloheksan, 4'ten fazla karbon atomlu bir döngü boyutuna sahip bir sikloalkandır. 4 karbon atomundan daha büyük bir döngü boyutuna sahip sikloalkanlar, halojenlerle etkileşime girdiğinde, döngüyü sürdürürken bir ikame reaksiyonuna girer: Minimum halka boyutuna sahip siklopropan ve siklobutan - sikloalkanlar, ağırlıklı olarak halka yırtılmasının eşlik ettiği ekleme reaksiyonlarına girer: Üçüncül karbon atomunda hidrojen atomlarının ikamesi, ikincil ve birincil karbon atomundan daha büyük ölçüde gerçekleşir. Böylece, izobütanın brominasyonu ağırlıklı olarak şu şekilde ilerler: Görev numarası 19 Reaksiyon şeması ile bu reaksiyonun ürünü olan organik madde arasında bir yazışma kurun: bir harfle gösterilen her pozisyon için bir sayı ile gösterilen ilgili pozisyonu seçin. Tabloda seçilen sayıları ilgili harflerin altına yazın.
Cevap: 6134 Açıklama: Aldehitlerin taze çökeltilmiş bakır hidroksitle ısıtılması, aldehit grubunun karboksil grubuna oksidasyonuna yol açar: Aldehitler ve ketonlar, nikel, platin veya paladyum varlığında hidrojen ile alkollere indirgenir: Birincil ve ikincil alkoller, akkor CuO tarafından sırasıyla aldehitlere ve ketonlara oksitlenir: Konsantre sülfürik asit ısıtıldığında etanol üzerinde etki yaptığında, iki farklı ürünün oluşması mümkündür. 140 ° C'nin altındaki sıcaklıklara ısıtıldığında, ağırlıklı olarak dietil eter oluşumu ile moleküller arası dehidrasyon meydana gelir ve 140 ° C'den fazla ısıtıldığında, etilenin oluştuğu intramoleküler dehidrasyon meydana gelir: Görev numarası 20 Önerilen maddeler listesinden, termal ayrışma reaksiyonu redoks olan iki madde seçin. 1) alüminyum nitrat 2) potasyum bikarbonat 3) alüminyum hidroksit 4) amonyum karbonat 5) amonyum nitrat Cevap alanına seçilen maddelerin numaralarını yazın. Cevap: 15 Açıklama: Redoks reaksiyonları, kimyasal bir veya daha fazla kimyasal elementin oksidasyon durumunu değiştirmesinin bir sonucu olarak reaksiyonlardır. Kesinlikle tüm nitratların bozunma reaksiyonları redoks reaksiyonlarıdır. Mg'den Cu'ya kadar olan metal nitratlar, metal oksit, nitrojen dioksit ve moleküler oksijene ayrışır: Tüm metal bikarbonatlar, hafif ısıtmayla (60 °C) bile metal karbonat, karbon dioksit ve suya ayrışır. Bu durumda oksidasyon durumlarında bir değişiklik olmaz: Çözünmeyen oksitler ısıtıldığında ayrışır. Bu durumda reaksiyon redoks değildir çünkü tek bir kimyasal element bunun sonucunda oksidasyon durumunu değiştirmez: Amonyum karbonat ısıtıldığında karbondioksit, su ve amonyağa ayrışır. Reaksiyon redoks değildir: Amonyum nitrat, nitrik oksit (I) ve suya ayrışır. Reaksiyon, OVR'ye atıfta bulunur: Görev numarası 21 Önerilen listeden, nitrojenin hidrojen ile reaksiyon hızında bir artışa yol açan iki dış etki seçin. 1) sıcaklığı düşürmek 2) sistemdeki basınç artışı 5) bir inhibitör kullanmak Cevap alanına seçilen dış etkilerin numaralarını yazın. Cevap: 24 Açıklama: 1) sıcaklığı düşürmek: Herhangi bir reaksiyonun hızı, azalan sıcaklıkla azalır. 2) sistemdeki basınç artışı: Basıncın arttırılması, en az bir gaz halindeki maddenin dahil olduğu herhangi bir reaksiyonun hızını arttırır. 3) hidrojen konsantrasyonunda bir azalma Konsantrasyondaki bir azalma her zaman reaksiyon hızını yavaşlatır. 4) azot konsantrasyonunda artış Reaktiflerin konsantrasyonunun arttırılması her zaman reaksiyon hızını arttırır. 5) bir inhibitör kullanmak İnhibitörler, reaksiyon hızını yavaşlatan maddelerdir. Görev numarası 22 Bir maddenin formülü ile elektroliz ürünleri arasında bir yazışma oluşturun sulu çözelti inert elektrotlar üzerinde bu maddenin: bir harfle işaretlenmiş her bir pozisyon için, bir sayı ile işaretlenmiş ilgili pozisyonu seçin. Tabloda seçilen sayıları ilgili harflerin altına yazın.
Cevap: 5251 Açıklama: A) NaBr → Na + + Br - Na + katyonları ve su molekülleri katot için rekabet eder. 2H 2 O + 2e - → H 2 + 2OH - 2Cl - -2e → Cl 2 B) Mg (NO 3) 2 → Mg 2+ + 2NO 3 - Katot için Mg2+ katyonları ve su molekülleri birbirleriyle rekabet eder. katyonlar alkali metaller, magnezyum ve alüminyumun yanı sıra, yüksek aktiviteleri nedeniyle sulu bir çözelti koşulları altında geri kazanamazlar. Bu nedenle, onların yerine su molekülleri aşağıdaki denkleme göre restore edilir: 2H 2 O + 2e - → H 2 + 2OH - Anot için NO 3 - anyonları ve su molekülleri birbirleriyle rekabet eder. 2H 2 O - 4e - → O 2 + 4H + Yani cevap 2 (hidrojen ve oksijen) uygundur. B) AlCl 3 → Al 3+ + 3Cl - Alkali metallerin katyonlarının yanı sıra magnezyum ve alüminyum, yüksek aktivitelerinden dolayı sulu bir çözelti koşulları altında indirgenemezler. Bu nedenle, onların yerine su molekülleri aşağıdaki denkleme göre restore edilir: 2H 2 O + 2e - → H 2 + 2OH - Cl - anyonları ve su molekülleri anot için rekabet eder. birinden oluşan anyonlar kimyasal element(F - hariç) anotta oksidasyon için su moleküllerinden rekabeti kazanın: 2Cl - -2e → Cl 2 Bu nedenle cevap 5 (hidrojen ve halojen) uygundur. D) CuSO 4 → Cu 2+ + SO 4 2- Aktivite serisinde hidrojenin sağındaki metal katyonları, sulu bir çözeltinin koşulları altında kolaylıkla indirgenir: Cu 2+ + 2e → Cu 0 En yüksek oksidasyon durumunda asit oluşturan bir element içeren asit kalıntıları, anotta oksidasyon için su moleküllerine karşı rekabetini kaybeder: 2H 2 O - 4e - → O 2 + 4H + Bu nedenle cevap 1 (oksijen ve metal) uygundur. Görev numarası 23 Tuzun adı ile bu tuzun sulu çözeltisinin ortamı arasında bir yazışma kurun: bir harfle işaretlenmiş her konum için, bir sayı ile gösterilen ilgili konumu seçin. Tabloda seçilen sayıları ilgili harflerin altına yazın.
Cevap: 3312 Açıklama: A) demir (III) sülfat - Fe 2 (SO 4) 3 zayıf bir "baz" Fe (OH) 3 ve güçlü bir asit H2S04 tarafından oluşturulur. Sonuç - asidik ortam B) krom (III) klorür - CrCl 3 zayıf bir baz Cr (OH) 3 ve güçlü bir asit HCl'den oluşur. Sonuç - asidik ortam C) sodyum sülfat - Na2S04 Güçlü baz NaOH ve güçlü asit H2S04'ten oluşur. Sonuç - tarafsız ortam D) sodyum sülfür - Na 2 S Güçlü baz NaOH ve zayıf asit H2S'den oluşur. Sonuç - ortam alkalidir. Görev numarası 24 Denge sistemini etkileme yolu arasında bir yazışma kurun CO (g) + Cl2 (g) COCl2 (g) + Q ve bu eylemin sonucu olarak kimyasal dengenin yer değiştirmesinin yönü: bir harfle gösterilen her konum için, bir sayı ile gösterilen ilgili konumu seçin. Tabloda seçilen sayıları ilgili harflerin altına yazın.
Cevap: 3113 Açıklama: Sistem üzerinde dış etki altında dengenin yer değiştirmesi, bu dış etkinin etkisini en aza indirecek şekilde gerçekleşir (Le Chatelier ilkesi). A) CO konsantrasyonundaki bir artış, dengede doğrudan reaksiyona doğru bir kaymaya yol açar, çünkü bunun sonucunda CO miktarı azalır. B) Sıcaklıktaki bir artış dengeyi endotermik bir reaksiyona kaydırır. Doğrudan reaksiyon ekzotermik (+ Q) olduğundan, denge ters reaksiyona doğru kayar. C) Basınçtaki bir azalma, dengeyi reaksiyona doğru kaydırır ve gazların miktarında bir artışa neden olur. Ters tepkimenin bir sonucu olarak, doğrudan bir tepkimenin sonucundan daha fazla gaz oluşur. Böylece denge zıt reaksiyona doğru kayar. D) Klor konsantrasyonundaki bir artış, bunun sonucunda klor miktarı azaldığından, dengede doğrudan reaksiyona doğru bir kaymaya yol açar. Görev numarası 25 İki madde ile bu maddeleri ayırt edebileceğiniz bir reaktif arasında bir ilişki kurun: bir harfle gösterilen her bir pozisyon için bir sayı ile gösterilen ilgili pozisyonu seçin. Cevap: 3454 Açıklama: İki maddeyi üçüncü maddenin yardımıyla ayırt etmek, ancak bu iki madde onunla farklı şekillerde etkileşime girerse mümkündür ve en önemlisi, bu farklılıklar dıştan ayırt edilebilir. A) FeSO 4 ve FeCl 2 çözeltileri baryum nitrat çözeltisi ile ayırt edilebilir. FeSO 4 durumunda, beyaz bir baryum sülfat çökeltisi oluşur: FeSO 4 + BaCl 2 = BaSO 4 ↓ + FeCl 2 FeCl2 durumunda, reaksiyon ilerlemediği için görünür bir etkileşim belirtisi yoktur. B) Na3P04 ve Na2S04 çözeltileri, MgCl2 çözeltisi kullanılarak ayırt edilebilir. Na2S04 çözeltisi reaksiyona girmez ve Na3P04 durumunda beyaz bir magnezyum fosfat çökeltisi çöker: 2Na 3P04 + 3MgCl 2 = Mg 3 (PO 4) 2 ↓ + 6NaCl C) KOH ve Ca (OH) 2 çözeltileri, Na 2 CO 3 çözeltisi ile ayırt edilebilir. KOH, Na2C03 ile reaksiyona girmez ve Ca (OH)2, Na2C03 ile beyaz bir kalsiyum karbonat çökeltisi verir: Ca (OH) 2 + Na2C03 = CaC03 ↓ + 2NaOH D) KOH ve KCl çözeltileri MgCl 2 çözeltisi kullanılarak ayırt edilebilir. KCl, MgCl2 ile reaksiyona girmez ve KOH ve MgCl2 çözeltilerinin karıştırılması, beyaz bir magnezyum hidroksit çökeltisinin oluşumuna yol açar: MgCl 2 + 2KOH = Mg (OH) 2 ↓ + 2KCl Görev numarası 26 Madde ile uygulama alanı arasında bir yazışma kurun: bir harfle gösterilen her pozisyon için bir sayı ile gösterilen ilgili pozisyonu seçin. Tabloda seçilen sayıları ilgili harflerin altına yazın.
Cevap: 2331 Açıklama: Amonyak - azotlu gübrelerin üretiminde kullanılır. Özellikle amonyak üretimi için bir hammaddedir. Nitrik asit, sırayla gübreler elde edilir - sodyum, potasyum ve amonyum nitrat (NaNO 3, KNO 3, NH 4 NO 3). Çözücü olarak karbon tetraklorür ve aseton kullanılır. Etilen, yüksek moleküler ağırlıklı bileşikler (polimerler), yani polietilen üretmek için kullanılır. 27-29 arası görevlerin cevabı sayıdır. Belirtilen doğruluk derecesini gözlemleyerek bu numarayı çalışma metnindeki cevap alanına yazın. Daha sonra bu numarayı ilk hücreden başlayarak ilgili görevin numarasının sağındaki CEVAP FORMU № 1'e aktarın. Formda verilen örneklere uygun olarak her bir karakteri ayrı bir kutuya yazınız. Fiziksel büyüklüklerin ölçü birimlerini yazmaya gerek yoktur. Görev numarası 27 Alkali kütle oranı %25 olan bir çözelti elde etmek için 150 g suda hangi kütle potasyum hidroksit çözülmelidir? (Sayıyı tamsayı olarak yazın.) Cevap: 50 Açıklama: 150 g suda çözülmesi gereken potasyum hidroksitin kütlesi x g'ye eşit olsun, o zaman elde edilen çözeltinin kütlesi (150 + x) g olacaktır ve böyle bir çözeltideki alkalinin kütle fraksiyonu x / (150 + x) olarak ifade edilebilir. Durumdan, potasyum hidroksitin kütle fraksiyonunun 0.25 (veya %25) olduğunu biliyoruz. Böylece, denklem geçerlidir: x / (150 + x) = 0.25 Böylece, kütle fraksiyonu %25 olan bir alkali olan bir çözelti elde etmek için 150 g suda çözülmesi gereken kütle, 50 g'a eşittir. Görev numarası 28 Termokimyasal denklemi olan reaksiyona MgO (katı) + CO2 (g) → MgC03 (katı) + 102 kJ, 88 gr karbondioksit girdi. Bu durumda ne kadar ısı açığa çıkacak? (Sayıyı tamsayı olarak yazın.) Cevap: ____________________________ kJ. Cevap: 204 Açıklama: Karbondioksit maddesi miktarını hesaplayalım: n (CO 2) = n (CO 2) / M (CO 2) = 88/44 = 2 mol, Reaksiyon denklemine göre, 1 mol CO2 magnezyum oksit ile etkileşime girdiğinde 102 kJ açığa çıkar. Bizim durumumuzda, karbondioksit miktarı 2 mol'dür. Bu durumda açığa çıkan ısı miktarını x kJ olarak ifade ederek aşağıdaki oranı yazabiliriz: 1 mol CO2 - 102 kJ 2 mol CO2 - x kJ Bu nedenle, denklem doğrudur: 1 ∙ x = 2 ∙ 102 Böylece, 88 g karbon dioksitin magnezyum oksit ile reaksiyona girmesiyle açığa çıkan ısı miktarı 204 kJ'dir. Görev numarası 29 2.24 L (NL) hidrojen üretmek için hidroklorik asit ile reaksiyona giren çinko kütlesini belirleyin. (Sayıyı onluğa kadar yazınız.) Cevap: ___________________________ Cevap: 6.5 Açıklama: Reaksiyon denklemini yazalım: Zn + 2HCl = ZnCl2 + H2 Hidrojen maddesinin miktarını hesaplayalım: n (H 2) = V (H 2) / Vm = 2.24 / 22.4 = 0.1 mol. Çinko ve hidrojenden önceki reaksiyon denkleminde eşit katsayılar olduğundan, bu, reaksiyona giren çinko ve bunun sonucunda oluşan hidrojen miktarlarının da eşit olduğu anlamına gelir, yani. n (Zn) = n (H 2) = 0.1 mol, bu nedenle: m (Zn) = n (Zn) ∙ M (Zn) = 0,1 ∙ 65 = 6,5 g. Tüm cevapları, çalışma talimatlarına uygun olarak 1 numaralı cevap formuna aktarmayı unutmayın. Görev numarası 33 43.34 g ağırlığındaki sodyum bikarbonat, sabit ağırlığa kadar kalsine edildi. Tortu, fazla hidroklorik asit içinde çözündürüldü. Nihai gaz, 100 g %10'luk bir sodyum hidroksit çözeltisinden geçirildi. Oluşan tuzun bileşimini ve kütlesini, çözeltideki kütle fraksiyonunu belirleyin. Cevapta, problem durumunda belirtilen reaksiyon denklemlerini yazın ve gerekli tüm hesaplamaları yapın (istenen fiziksel büyüklüklerin ölçüm birimlerini belirtin). Cevap: Açıklama: Sodyum bikarbonat, aşağıdaki denkleme göre ısıtıldığında ayrışır: 2NaHC03 → Na 2 CO 3 + CO 2 + H 2 O (I) Ortaya çıkan katı kalıntı, görünüşe göre sadece sodyum karbonattan oluşur. Sodyum karbonat içinde çözündüğünde hidroklorik asit aşağıdaki reaksiyon oluşur: Na 2 CO 3 + 2HCl → 2NaCl + CO 2 + H 2 O (II) Sodyum bikarbonat ve sodyum karbonat maddesinin miktarını hesaplayın: n (NaHC03 3) = m (NaHC03 3) / M (NaHC03 3) = 43.34 g / 84 g / mol ≈ 0.516 mol, buradan, n (Na2C03) = 0,516 mol / 2 = 0,258 mol. Tepkime (II) ile oluşan karbondioksit miktarını hesaplayalım: n (CO 2) = n (Na2C03) = 0.258 mol. Saf sodyum hidroksitin kütlesini ve madde miktarını hesaplıyoruz: m (NaOH) = m solüsyon (NaOH) ∙ ω (NaOH) / %100 = 100 g ∙ %10 / %100 = 10 g; n (NaOH) = m (NaOH) / M (NaOH) = 10/40 = 0.25 mol. Karbondioksitin sodyum hidroksit ile etkileşimi, oranlarına bağlı olarak iki şekilde ilerleyebilir. farklı denklemler: 2NaOH + CO 2 = Na 2 CO 3 + H 2 O (fazla alkali ile) NaOH + CO2 = NaHC03 (fazla karbon dioksit ile) Sunulan denklemlerden, n (NaOH) / n (CO 2) ≥2 oranıyla sadece orta tuzun ve n (NaOH) / n (CO 2) ≤ 1 oranıyla sadece asidik elde edilir. Hesaplamalara göre, ν (CO 2)> ν (NaOH), dolayısıyla: n (NaOH) / n (CO 2) ≤ 1 Onlar. karbon dioksitin sodyum hidroksit ile etkileşimi, yalnızca asidik bir tuzun oluşumu ile gerçekleşir, yani. denkleme göre: NaOH + CO2 = NaHC03 (III) Hesaplama alkali eksikliği için yapılır. Reaksiyon denklemine göre (III): n (NaHC03 3) = n (NaOH) = 0.25 mol, bu nedenle: m (NaHC03 3) = 0.25 mol ∙ 84 g / mol = 21 g. Elde edilen çözeltinin kütlesi, alkali çözeltinin kütlesi ile onun tarafından emilen karbondioksit kütlesinin toplamı olacaktır. Reaksiyon denkleminden reaksiyona girdiği, yani. 0.258 molün sadece 0.25 mol CO2'sini emmiştir. O halde absorbe edilen CO2 kütlesi: m (CO 2) = 0.25 mol ∙ 44 g / mol = 11 g. O halde çözeltinin kütlesi şuna eşittir: m (çözelti) = m (NaOH çözeltisi) + m (CO 2) = 100 g + 11 g = 111 g, ve çözeltideki sodyum bikarbonatın kütle fraksiyonu şuna eşit olacaktır: ω (NaHC03 3) = 21 g / 111 g ∙ %100 ≈ %18,92. Görev numarası 34 16,2 g siklik olmayan organik maddenin yanması üzerine 26,88 L (NU) karbon dioksit ve 16,2 g su elde edildi. Bu organik maddenin 1 molünün bir katalizör varlığında sadece 1 mol su eklediği ve bu maddenin amonyak gümüş oksit çözeltisi ile reaksiyona girmediği bilinmektedir. Verilen problem koşullarına göre: 1) organik maddenin moleküler formülünü oluşturmak için gerekli hesaplamaları yapar; 2) organik maddenin moleküler formülünü yazın; 3) molekülündeki atomların bağlarının sırasını açık bir şekilde yansıtan organik maddenin yapısal formülünü oluşturur; 4) Organik maddenin hidrasyonu için reaksiyon denklemini yazar. Cevap: Açıklama: 1) Element bileşimini belirlemek için, karbon dioksit, su ve daha sonra bunlara dahil olan elementlerin kütlelerinin miktarını hesaplarız: n (CO2) = 26.88 L / 22.4 L / mol = 1.2 mol; n (CO2) = n (C) = 1.2 mol; m (C) = 1.2 mol ∙ 12 g / mol = 14,4 g. n (H20) = 16,2 g / 18 g / mol = 0,9 mol; n (H) = 0.9 mol * 2 = 1.8 mol; m (H) = 1.8 gr. m (org. maddeler) = m (C) + m (H) = 16,2 g, bu nedenle organik maddede oksijen yoktur. Genel formül organik bileşik- CxHy. x: y = ν (C): ν (H) = 1.2: 1.8 = 1: 1.5 = 2: 3 = 4: 6 Böylece, bir maddenin en basit formülü C 4 H6'dır. Bir maddenin gerçek formülü, en basit formülle örtüşebilir veya ondan bir tamsayı kadar farklı olabilir. Onlar. örneğin, C 8 H 12, C 12 H 18, vb. Koşul, hidrokarbonun siklik olmadığını ve moleküllerinden birinin yalnızca bir su molekülü ekleyebileceğini söylüyor. Bu, bir maddenin yapısal formülünde yalnızca bir çoklu bağ (ikili veya üçlü) varsa mümkündür. İstenen hidrokarbon siklik olmadığından, bir çoklu bağın yalnızca C4H6 formülüne sahip bir madde için olabileceği açıktır. Molekül ağırlığı daha yüksek olan diğer hidrokarbonlar söz konusu olduğunda, çoklu bağların sayısı her yerde birden fazladır. Böylece, C4H6 maddesinin moleküler formülü en basit olanla örtüşür. 2) Organik maddenin moleküler formülü C4H6'dır. 3) Hidrokarbonlardan, molekülün sonunda üçlü bir bağ bulunan alkinler, bir amonyak gümüş oksit çözeltisi ile etkileşime girer. Gümüş oksidin amonyak çözeltisi ile etkileşim olmaması için, C4H6 bileşiminin alkininin aşağıdaki yapıya sahip olması gerekir: CH 3 -C≡C-CH3 4) Alkinlerin hidrasyonu, iki değerli cıva tuzlarının varlığında meydana gelir. |
| Okumak: |
|---|
Popüler:
Yeni
- İngilizce Londra Simgeleri: açıklama ve fotoğraflar Nesneyi tanımlamak için özellikler
- Toplama kuralları
- Temel Selamlaşma Biçimleri (Nihao Çeviri)
- Öbek fiil TURN, ifadeler ve deyimler
- BelZhD'nin çevrimiçi bir puan tablosu var
- ivme nedir? Hız. hızlanma Eğer vücut hızlanırsa
- Word'deki menü şablonları: indirin ve yazdırın
- Bayes teoreminin basit matematiği
- Pearson korelasyon kriteri Korelasyon katsayısı 1 ortalama
- Bulanık ve rastgele kümeler Önerme cebirinin temel denklikleri