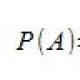Sitenin bölümleri
Editörün Seçimi:
- Pazar Okulu Mezuniyet (Toosh) Pazar Okulu Mezuniyet Belgesi
- Kutsal doktor-şehit Eugene Botkin
- Tutkulu Evgeny Botkin
- Kaygı, korku ve endişeden nasıl kurtulurum
- Erkek psikolojisinde "Napolyon kompleksi" Napolyon sendromu nedir
- Evgeny botkin
- Kadın sesi: sınıflandırma, en düşük ve en yüksek kadın sesi
- Aydınlanma (uyanış) deneyiminden sonra yaşam nasıl değişir?
- Testin ana noktaları
- Ölüm korkusundan nasıl kurtulur: tavsiye ve psikoterapötik yardım
reklam
| Hangi denklem termodinamiğin birinci yasasını ifade eder. Termodinamiğin birinci yasası. Isı dengesi denklemi |
|
Termodinamiğin birinci yasası Plan İçsel enerji. İzoprosesler. İzoproses çalışır. Adyabatik süreç. Isı kapasitesi. Vücudun iç enerjisi. Bir cismin iç enerjisi, moleküllerin öteleme ve dönme hareketinin kinetik enerjisinden, moleküllerdeki atomların titreşim hareketinin kinetik ve potansiyel enerjisinden, moleküller arasındaki etkileşimin potansiyel enerjisinden ve molekül içi enerjiden (intranükleer) oluşur. Vücudun bir bütün olarak kinetik ve potansiyel enerjisi iç enerjiye dahil değildir. Vücutların termodinamik sisteminin iç enerjisi, cisimler arasındaki etkileşimin iç enerjisinden ve her cismin iç enerjisinden oluşur. Bir termodinamik sistemin dış cisimler üzerindeki çalışması, bu cisimlerin durumunun değiştirilmesinden oluşur ve termodinamik sistemin dış cisimlere aktardığı enerji miktarı ile belirlenir. Isı, ısı değişimi sırasında sistemin dış cisimlere sunduğu enerji miktarıdır. İş ve ısı, sistemin durumunun işlevleri değil, bir durumdan diğerine geçişin bir işlevidir. Bir termodinamik sistem, kendi aralarında ve dış ortamla (diğer cisimlerle) (örneğin, bir sıvı ve üzerinde bulunan buhar) enerji alışverişi yapabilen bir dizi makroskopik cisim olan böyle bir sistemdir. Termodinamik sistem aşağıdaki parametrelerle karakterize edilir: P, V, T, ρ vesaire. Parametrelerden en az birinin değiştiği sistemin durumlarına dengesiz durumlar denir. Dış cisimlerle enerji alışverişi yapmayan termodinamik sistemlere kapalı denir. Termodinamik süreç, bir sistemin bir durumdan geçişidir (P 1 , V 1 , T 1 ) başka bir (P 2 , V 2 , T 2 ) - sistemdeki dengesizlik. Termodinamiğin birinci yasası. Sisteme verilen ısı miktarı, sistemin iç enerjisini arttırmak ve sistem tarafından dış cisimler üzerinde çalışmak için kullanılır. Termodinamiğin birinci yasası, sistemin iç enerjisini hesaba katan enerjinin korunumu yasasının özel bir halidir: Q= sen 2 - sen 1 + A; sen 1, sen 2 - vücudun iç enerjisinin ilk ve son değerleri. A- sistem tarafından yapılan iş. Q- Sisteme verilen ısı miktarı. Diferansiyel: NS Q= dU+ NS A; dU- toplam bir diferansiyel vardır ve sistemin ilk ve son durumları arasındaki farka bağlıdır. NS QveNS A- tamamlanmamış farklılıklar, sürecin kendisine, yani sürecin yoluna bağlıdır. Hacim değiştiğinde iş yapılır: NS A= fdx= pSdx = pdV; NS A= pdV; Termodinamiğin birinci yasası, birinci türden sürekli hareket eden bir makinenin, yani dışarıdan aldığı enerjiden daha fazla miktarda iş yapacak bir motorun imkansız olmasıdır.
- entegrasyon yoluna bağlı değildir.
- süreç fonksiyonunun entegrasyon yoluna bağlıdır ve yazılamaz: A 2 - A 1 ; Q 2 - Q 1 ; A, Q- devletin işlevleri değildir. Çalışma ve sıcaklık yasası hakkında konuşamazsınız. Bu, enerjinin korunumu yasasından başka bir şey değildir. İzoprosesler. 1) İzokorik süreç: V =ile birlikteonst; Kapalı bir hacimde gaz ısıtma işlemi. NS Q = dU + pdV, pdV = 0; NS U = dU, Termodinamiğin birinci yasası bu formu alır. Özgül ısıV- const:
Isı kapasitesi, sistem tarafından alınan ısı artışının sıcaklıktaki artışa oranı ile belirlenir.
2) İzobarik süreç: P= const; NS Q= dU+ NS A; BölmekdT(1 mol gaz için):
KP= Özgeçmiş+ r, 3) İzotermal süreç: T= const, P V = A; İç enerji bağlı olduğundanT, sonra izotermal genişleme iledU=0: NS Q= NS A, İzotermal genleşme sırasında gaza verilen ısı tamamen genleşme işine dönüştürülür.
dQ∞ eğilimindedir,dT0'a eğilimlidir. 4) Adyabatik süreç: ile ısı alışverişi olmadan Çevre... Termodinamiğin birinci yasası şu şekli alır: NS S = 0; dU + d bir = 0, dU + d bir = 0; NS A = -dU, Adyabatik bir süreçte, yalnızca gazın iç enerjisinin kaybı nedeniyle iş yapılır.
Hangi süreçlerdeNS Q= 0 - adyabatik. Adyabatik süreçlere her zaman vücut sıcaklığındaki bir değişiklik eşlik eder. Adyabatik genişleme sırasında, iç enerji nedeniyle iş yapılır (1 cal = 4.19 J). İzoprocesses ile çalışın. 1) İzokorik süreç: V= const NS A= pdV=0; A v =0, Bir denge sürecindeki basınç kuvvetlerinin işi, süreci gösteren eğrinin altındaki alana sayısal olarak eşittir.PV- diyagram: NS A= pdV. 2) İzobarik süreç: p = sabit; NS A = pdV;
3) İzotermal süreç: T= const; NS A=
pdV;
dV = RT;
Denge süreci:
4) Adyabatik süreç: NS Q= dU+ pdV; dU = -pdV, NS S = 0; dU = C v dT,
Entegre ediyoruz:
+ (γ-1) lnV = sabit, (TELEVİZYON y-1 ) = sabit, (TELEVİZYON y-1 ) = sabit -denklemzehir
;
rV γ = const. 6. Isı kapasitesi. 1) Bir cismin ısı kapasitesi, cismin 1 derece ısınması için vücuda iletmesi gereken ısı miktarıdır. 0 İLE BİRLİKTE.
C P = C V + r; C P > C V,
Isı kapasitesi, bir kütle birimi, bir mol ve bir hacim birimi ile ilişkilendirilebilir. Buna göre: spesifik, molar, hacimsel ([J / kg * derece]; [J / mol * derece]; [J / m 3* Kent]). 2) Gerçek gazlarda ısı kapasitesi: İçsel dua eden enerji: n a k= r,
; – sabit basınçta bir molün ısı kapasitesi (P= const). Özısı.
Devlet işlevi. W= sen+ PV; C P > C v
P korunarak ısıtıldığında, parçaQgenişlemeye gider. Sadece genişleterek R olabilir. İzoterm:PV= const; Adyabat:PV γ = const;
PV γ γ> 1 olduğundan, adyabatik eğri izotermden daha diktir.
C v dT + pdV = 0; NS A = pdV = - C v dT;
PV γ = P 1 V 1 γ ,
Temel termodinamik kavramlar: iç enerji, iş, ısı. Termodinamiğin birinci yasasının denklemi.
İçsel enerji- enerji fiziksel sistem ona bağlı iç durum... İç enerji enerji içerir kaotik (termal) hareket sistemin tüm mikropartikülleri (moleküller, atomlar, iyonlar vb.) ve bu parçacıkların etkileşim enerjisi... Sistemin bir bütün olarak hareketinin kinetik enerjisi ve dış kuvvet alanlarındaki potansiyel enerjisi iç enerjiye dahil değildir. Termodinamiğe ve uygulamalarına ilgi anlamın kendisi değil iç enerji ve onun değişimi sistemin durumu değiştiğinde. İç enerji, sistemin durumunun bir fonksiyonudur. Çalışmak dış cisimler üzerinde termodinamik sistem oluşur bu organların durumunu değiştirirken ve hacim değiştiğinde sistem tarafından dış cisimlere aktarılan enerji miktarı ile belirlenir.
Sıcaklık(ısı miktarı) - ısı değişimi sırasında sistem tarafından alınan veya verilen enerji miktarı... Temel ısı miktarı  genellikle bir diferansiyel değildir durum parametrelerinin herhangi bir işlevi. Sisteme aktarılan ısı miktarı, iş gibi, sistem nasıl gidiyor ilk durumdan son duruma. (İç enerjiden farklı olarak, genellikle bir diferansiyel değildir durum parametrelerinin herhangi bir işlevi. Sisteme aktarılan ısı miktarı, iş gibi, sistem nasıl gidiyor ilk durumdan son duruma. (İç enerjiden farklı olarak,  , ancak , ancak  , vücudun ne kadar iş içerdiğini söylemek imkansızdır, sürecin “bu bir işlevidir” - dinamik bir özellik). , vücudun ne kadar iş içerdiğini söylemek imkansızdır, sürecin “bu bir işlevidir” - dinamik bir özellik). Termodinamiğin 1. yasası (başlangıç): Sisteme verilen ısı miktarı, sistemin iç enerjisinin artışına ve sistemin dış cisimler üzerinde çalışmasına gider..
nerede  vücuda verilen ısı miktarı; vücuda verilen ısı miktarı;
Diferansiyel formda, 1. başlangıç:
 vücuda verilen temel ısı miktarı; vücuda verilen temel ısı miktarı;
 (Yunanca) - eşit). Bazı sabit parametrelerde meydana gelen işlemler ( (Yunanca) - eşit). Bazı sabit parametrelerde meydana gelen işlemler (  izotermal; izotermal;  izobarik; izobarik;  izokorik). izokorik). Isı kapasitesi
Vücut ısı kapasitesinin boyutu  . .
1 mol (molar ısı kapasitesi
 , sonra , sonra  . .
Sonra
 . .
1 mol için ideal bir gaz için (Mendeleev-Clapeyron denkleminden).
Bu ifadeleri T sıcaklığına göre ayırt ederiz, şunu elde ederiz:
Ama ifade denir Mayer denklemi... Bunu gösteriyor  her zaman daha fazla her zaman daha fazla  molar gaz sabitinin değeri ile. Bu şu şekilde açıklanır: gazı sabit basınçta ısıtırken sabit hacimli bir işlemle karşılaştırıldığında, gaz genleşme işini gerçekleştirmek için ek bir ısı miktarı gereklidir, dan beri sabit basınç, gaz hacmindeki bir artışla sağlanır. molar gaz sabitinin değeri ile. Bu şu şekilde açıklanır: gazı sabit basınçta ısıtırken sabit hacimli bir işlemle karşılaştırıldığında, gaz genleşme işini gerçekleştirmek için ek bir ısı miktarı gereklidir, dan beri sabit basınç, gaz hacmindeki bir artışla sağlanır.
 , ,  , yani adyabatik süreçte ısı kapasitesi sıfırdır. , yani adyabatik süreçte ısı kapasitesi sıfırdır.  olduğu süreçler vardır. genleşen gaz işe yarıyor alınan ısıdan daha büyük, o zaman sıcaklık düşerısı akışına rağmen. Bu durumda özgül ısı olumsuz... Genel olarak  . .
3. İzoproseslerde gazın yaptığı iş izobarik
Ve Şekil 2'deki gölgeli dikdörtgenin alanı ile belirlenir. 14.2. izokorik süreç(). Bu işlemin şeması
İzotermal süreç, ideal süreç dan beri gazın sabit sıcaklıkta genleşmesi ancak sonsuz yavaş... Sonlu bir genişleme hızında, sıcaklık gradyanları görünecektir. 4. Adyabatik (adyabatik) süreç Bu, çevredeki cisimlerle ısı alışverişi olmadan gerçekleşen bir süreçtir.... Adyabatik süreci gerçekçi bir şekilde uygulamanın veya ona yaklaşmanın hangi koşullar altında mümkün olduğunu düşünelim. 1. Gerekli adyabatik kabuk, termal iletkenliği sıfırdır. Böyle bir kabuğa bir yaklaşım olabilir Dewar gemisi. 2. 2. durum - çok hızlı süreçler... Isının yayılma zamanı yoktur ve bir süre için varsayılabilir. 3. Meydana gelen süreçler çok büyük gaz hacimlerinde, örneğin atmosferde (siklon alanları, antisiklonlar). Sıcaklığı eşitlemek için, ısı transferi komşu, daha ısıtılmış hava katmanlarından gerçekleşmelidir, bu genellikle uzun zaman alır. Adyabatik bir süreç için termodinamiğin birinci yasası:
veya Gaz genleşmesi durumunda
Denklemin her iki tarafını da
Mayer denkleminden
biz belirtiriz
Bu denklemi entegre edelim:
Buradan
NS Poisson denklemi(adyabat için) (1. form). Yer değiştirmek
| |||||||||||||||||||||||
|
Pirinç. 14.5 |
|||||||||||||||||||||||
 |
Carnot döngüsü aşağıdaki gibidir... İlk başta sistem, bir sıcaklığa sahip  , verilen ısıtıcı ile termal temas halinde... Daha sonra, dış basıncı sonsuza kadar yavaşça azaltarak, genişlemeye zorlanır. izoterm 1-2... Bunu yaparken, o ısınır , verilen ısıtıcı ile termal temas halinde... Daha sonra, dış basıncı sonsuza kadar yavaşça azaltarak, genişlemeye zorlanır. izoterm 1-2... Bunu yaparken, o ısınır  ısıtıcıdan ve üretir İş ısıtıcıdan ve üretir İş  dış basınca karşı. dış basınca karşı.
|
 – buzdolabı(veya soğutucu). Rezervuarlar o kadar büyüktür ki, ısının serbest bırakılması veya alınması sıcaklıklarını değiştirmez.
– buzdolabı(veya soğutucu). Rezervuarlar o kadar büyüktür ki, ısının serbest bırakılması veya alınması sıcaklıklarını değiştirmez. Bundan sonra sistem adyabatik olarak izole edilir ve zorlanır. adiabat boyunca genişle 2 - 3 sıcaklığı buzdolabının sıcaklığına ulaşana kadar. NS adyabatik genişleme sistem ayrıca dış basınca karşı da bazı işler yapar. Durum 3'te sistem şu duruma getirilir: buzdolabı ile termal temas ve sürekli basınçtaki bir artış onu izotermal olarak sıkıştırır bir duruma 4. Bu durumda, sistem üzerinde iş yapılır (yani sistemin kendisi olumsuz iş yapar  ) ve buzdolabına biraz verir ısı miktarı
) ve buzdolabına biraz verir ısı miktarı  . Durum 4 seçilebilir böylece adiabat 4 - 1 boyunca sıkıştırma yoluyla sistemi orijinal durumuna döndürmek mümkündür. Bunun için sistem üzerinde çalışma yapılmalıdır.
. Durum 4 seçilebilir böylece adiabat 4 - 1 boyunca sıkıştırma yoluyla sistemi orijinal durumuna döndürmek mümkündür. Bunun için sistem üzerinde çalışma yapılmalıdır.  (sistem negatif iş yapmalıdır
(sistem negatif iş yapmalıdır  ). Döngüsel Carnot işlemi sonucunda sistemin iç enerjisi değişmez, bu nedenle yapılan iş
). Döngüsel Carnot işlemi sonucunda sistemin iç enerjisi değişmez, bu nedenle yapılan iş 

hadi hesaplayalım katsayı faydalı eylem ideal ısı motoru Carnot döngüsünde çalışır. Bu değer davranışısı miktarı işe dönüştü, alınan ısı miktarına ısıtıcıdan.
 |
Döngü başına faydalı iş, döngünün ayrı bölümlerinin tüm çalışmalarının toplamına eşittir:
İzotermal genleşme çalışması:
 ,
,
adyabatik genişleme:
 ,
,
izotermal sıkıştırma:
 ,
,
adyabatik sıkıştırma:
adyabatik bölgelerÇevrim etkilememek genel sonuca göre, çünkü onlar için çalış eşit ve zıt işaretle, bu nedenle  .
.
 . (1)
. (1)
2. ve 3. noktalarda tanımlanan gaz durumları aynı adiyabat üzerinde bulunduğundan, gaz parametreleri Poisson denklemi ile ilişkilidir:
 .
.
Benzer şekilde 4 ve 1 numaralı noktalar için:

Bu denklemleri terime bölerek şunu elde ederiz:



 , sonra (1)'den elde ederiz
, sonra (1)'den elde ederiz
 |
Yani Carnot çevriminin verimliliği sadece ısıtıcı ve buzdolabının sıcaklıkları ile belirlenir..
Carnot teoremi(kanıt yok): Isıtıcı ve buzdolabının aynı sıcaklıklarında çalışan tüm tersinir makinelerin verimi aynıdır ve sadece ısıtıcı ve buzdolabının sıcaklıkları ile belirlenir..
Yorum Yap: Gerçek verimlilikısı motoru her zaman aşağıda ideal bir ısı motorunun verimliliğinden daha fazla (gerçek bir makinede ısı kaybı ideal makine düşünüldüğünde dikkate alınmaz).
3. Bir ısı motorunun ve bir soğutma makinesinin çalışma prensibi
Herhangi bir ısı motoru şunlardan oluşur: 3 ana bölümden: çalışma sıvısı, ısıtıcı ve buzdolabı.
Çalışma sıvısı, ısıtıcıdan belirli bir miktarda ısı alır. Gaz sıkıştırıldığında, bir miktar ısıyı buzdolabına aktarır. alınan iş motor tarafından çevrim başına gerçekleştirilir:
(Not: gerçek ısı motorları genellikle sözde açık döngü genleşmeden sonra gaz olduğunda atılmış, ve yeni bir kısım sıkıştırılır... Ancak bu, prosesin termodinamiğini önemli ölçüde etkilemez. V kapalı döngü genişler ve daralır aynı kısım.).
soğutma makinesi... Carnot çevrimi tersine çevrilebilir, bu nedenle gerçekleştirilebilir. v ters yön
... (4-3-2-1-4 (Şekil 15.3)) Kimden buzdolabı bölmesi ısıyı emer .
 |
Isıtıcıçalışma sıvısı belirli bir miktar transfer eder sıcaklık  ... Dış güçler işi yapar ... Dış güçler işi yapar  , sonra , sonra
Döngünün bir sonucu olarak Soğuk bir cisimden daha yüksek sıcaklığa sahip bir cisme bir miktar ısı aktarılır. Yok canım Soğutma ünitesindeki çalışma sıvısı genellikle düşük kaynama noktalı sıvıların buharları- amonyak, freon vb. Makineye enerji verilir. |
|
Pirinç. 15.3 |
elektrik ağı. Bu enerji sayesinde süreç gerçekleşir” ısı transferi”Soğuk depodan daha sıcak bedenlere (çevreye).
soğutma verimliliği performans katsayısı ile tahmin edilir:
 |
Isı pompası.İş pahasına sürekli çalışan bir makinedir.  (elektrik) ısıyı alır düşük sıcaklığa sahip bir kaynaktan (çoğunlukla yakın ortam sıcaklığına) ve daha yüksek sıcaklıktaki bir ısı kaynağına transfer olur
(elektrik) ısıyı alır düşük sıcaklığa sahip bir kaynaktan (çoğunlukla yakın ortam sıcaklığına) ve daha yüksek sıcaklıktaki bir ısı kaynağına transfer olur  ısı miktarı toplam düşük sıcaklıklı bir kaynaktan alınan ısı ve harcanan iş:
ısı miktarı toplam düşük sıcaklıklı bir kaynaktan alınan ısı ve harcanan iş:  .
.
her zaman birden büyük (mümkün olan maksimum  ).
).
Karşılaştırma için: eğer odayı ısıtırsanız geleneksel elektrikli ısıtıcılar, sonra ısı miktarıısıtma elemanlarına tahsis edilmiş, tam olarak güç tüketimine eşit.
4 . Entropi. Artan entropi yasası
Termodinamikte "entropi" kavramı Alman fizikçi R. Clausius (1865) tarafından tanıtıldı.
Statik fizikten: ısı miktarının oranı  Sisteme sıcaklığa bildirilir
Sisteme sıcaklığa bildirilir  (sistem) bazı durum işlevlerinin artışıdır(entropi).
(sistem) bazı durum işlevlerinin artışıdır(entropi).
Vücudun her durumu, belirli bir entropi değeri ile karakterize edilir. Durum 1 ve 2'deki entropiyi şöyle gösterirsek  ve
ve  , ardından geri dönüşümlü işlemler için tanım gereği:
, ardından geri dönüşümlü işlemler için tanım gereği:
 |
Entropinin belirlendiği keyfi bir sabitin değeri önemli değildir. Fiziksel anlamda entropinin kendisine değil, entropilerin farkına sahiptir..
Artan entropi yasası.
Yalıtılmış bir sistemin bir denge noktasından geçtiğini varsayalım.
 |
(ters işlem için “=” işareti, geri dönüşü olmayan “1 - 2 - 1 geçişimiz için:

 .
.
2 - 1 işlemi tersine çevrilebilir olduğundan eşitlik olacaktır. ( Artan entropi yasası).
5. İstatistiksel ağırlık (termodinamik olasılık).
Altında termodinamik olasılık anlaşıldı mikro durum sayısı(mikro dağılımlar, örneğin moleküllerin uzay veya enerjideki dağılımları) makro dağılımı.
3. ve 4. - birincide vb. (şek.15.5).
|
, |
sabit),
nerede  Boltzmann sabiti,
Boltzmann sabiti,  termodinamik olasılık.
termodinamik olasılık.
Termodinamiğin ikinci yasası ve istatistiksel yorumu
Boltzmann'ın formülasyonu:
Clausius'un ifadesi:
 .
.
 , sonra
, sonra 
Bunun anlamı, her biri için  geçiş durumları
geçiş durumları  Sıcaklığı 301 K olan bir cisimden 300 K olan bir cisme aynı miktarda ısının 300 K olan bir cisimden 301 K olan bir cisme aktarılması bir durum meydana gelebilir. (Çok az miktarda ısı için
Sıcaklığı 301 K olan bir cisimden 300 K olan bir cisme aynı miktarda ısının 300 K olan bir cisimden 301 K olan bir cisme aktarılması bir durum meydana gelebilir. (Çok az miktarda ısı için  olasılıklar karşılaştırılabilir hale gelir ve bu gibi durumlarda ikinci ilke artık uygulanamaz.).
olasılıklar karşılaştırılabilir hale gelir ve bu gibi durumlarda ikinci ilke artık uygulanamaz.).
Genel olarak konuşursak, sistem çok değişkenli yollara, süreçlere sahipse, o zaman, Son durumların entropisini hesaplayarak, belirli bir yolun, sürecin olasılığını teorik olarak belirlemek mümkündür. aslında onları üretmeden ve bu, termodinamik olasılığı entropi ile birleştiren formülün önemli bir pratik uygulamasıdır.
Otokontrol için sorular

KAYNAKÇA LİSTESİ
1.Irodov I.E.... Makrosistemlerin fiziği. - M. - S. - Pb.: Fizmatlit,
2. Saveliev IV... Genel fizik kursu: 3 ciltte - M.: Nauka, 1977. V.1. - 432p.
3.Matveev A.N. moleküler fizik... - M.: Daha yüksek. Şk., 1987.
4.Sivukhin D.V. Genel fizik dersi: 5v'de. - M.: Nauka, 1975.v.2.
5.Telesnin R.V.... Moleküler fizik. - M.: Daha yüksek. shk., 1973.-
6.Zisman G.A., Todes O.M. Genel fizik kursu: 3v. - M .:
Bilim., 1969. T 1. - 340s.
7.Trofimova T.I.... Fizik kursu. - M.: Daha yüksek. shk., 1990 .-- 478s.
8.V.N. Kunin... Fiziğin zor bölümleriyle ilgili ders notları
Vladimir. politeknik in-t. - Vladimir, 1982 / - 52'ler.
9. Fizik. Program, yönergeler ve görevler
yazışma öğrencileri (çözüm örnekleri ile) / Comp .: A.F. Gal-
akraba, A.A. Kulish, V.N. Kunin ve diğerleri; Ed. AA Kuliş; Vla-
loş. durum un-t. - Vladimir, 2002 .-- 128p.
10. Yönergeler bağımsız iş fi tarafından
zike / Comp.: E.V. Orlik, E.D. Korzh, V.G. Prokoşev; Vladimir.
durum un-t. - Vladimir, 1988 .-- 48p.
Ders numarası 7. moleküler kinetik teori
ideal gaz ……………………………………………… .4
Ders numarası 8. klasik istatistik unsurları
(istatistiksel fizik) …………………………………… 12
Ders numarası 9. gerçek gazlar ………………………………………………… ..25
Ders numarası 10. sıvıların özellikleri ………………………………………… .32
Ders numarası 11. katıların özellikleri …………………………………… ....... 40
Ders numarası 12. faz dengeleri ve faz geçişleri ………… .47
Isı ve iş gibi fiziksel süreçler, enerjinin bir vücuttan diğerine basit transferi ile açıklanabilir. İş durumunda, mekanik enerjiden bahsediyoruz, ısı ise termal enerjiyi gerektiriyor. Enerji transferi termodinamik yasalarına göre gerçekleştirilir. Bu fizik dalının ana noktaları "başlangıçlar" olarak bilinir.
Termodinamiğin birinci yasası, belirli bir sistemdeki enerji transfer sürecini düzenler ve sınırlar.
Enerji sistemleri türleri
Fiziksel dünyada iki tür enerji sistemi vardır. Kapalı veya kapalı bir sistem sabit bir kütleye sahiptir. Açık veya açık bir sistemde, bu sistemde gerçekleşen işlemlere bağlı olarak kütle azalabilir veya artabilir. Gözlenen sistemlerin çoğu açık uçludur.
Bu tür sistemlerdeki araştırmalar, sonuçların güvenilirliğini etkileyen birçok rastgele faktör tarafından engellenmektedir. Bu nedenle fizikçiler, gerekli düzeltmeleri hesaba katarak, sonuçları açık olanlara tahmin ederek, kapalı sistemlerdeki fenomenleri inceler.
Yalıtılmış bir sistemin enerjisi
Çevre ile enerji alışverişi olmayan her türlü kapalı sistem izole edilir. Böyle bir sistemin denge durumu, bu tür miktarların okunmasıyla belirlenir:
- P sistemdeki basınçtır;
- V - izole edilmiş sistemin hacmi
- T sıcaklıktır;
- n, sistemdeki gazın mol sayısıdır;
gördüğünüz gibi ısı miktarı ve yapılan iş bu listeye dahil değildir. Kapalı bir yalıtımlı sistem ısı alışverişi yapmaz ve iş yapmaz. Toplam enerjisi değişmeden kalır.
Sistem enerji değişimi
İş bittiğinde veya bir ısı değişim süreci meydana geldiğinde, sistemin durumu değişir ve artık izole olarak kabul edilmeyecektir.
Termodinamiğin birinci yasasının formülasyonu
Her şeyden önce, termodinamiğin birinci yasası yalıtılmış sistemler için türetilmiştir. Daha sonra, yasanın evrensel olduğu ve sistemdeki madde miktarındaki dalgalanmalar nedeniyle oluşan iç enerjideki değişimi doğru bir şekilde hesaba katarsak açık sistemlere uygulanabileceği kanıtlandı. İncelenen sistem A durumundan B durumuna geçerse, sistem tarafından yapılan iş W ve ısı miktarı Q farklılık gösterecektir. Farklı süreçler, sistem sonunda orijinal durumuna dönse bile, bu değişkenlerin farklı okumalarını verir. Ama aynı zamanda fark W- Q hep aynı olacak. Başka bir deyişle, bir etkiden sonra sistem orijinal durumuna geri dönerse, böyle bir sistemin dönüşümünde yer alan süreçlerin türünden bağımsız olarak, kurala uyulur. W- Q= const.
Bazı durumlarda, birinci yasayı ifade etmek için diferansiyel formülü kullanmak daha uygundur. Şuna benziyor: dU = dW- dQ
Burada dU- iç enerjide sonsuz küçük değişiklik
dW- sistemin sonsuz küçük çalışmasını karakterize eden miktar
dQ- belirli bir sisteme aktarılan sonsuz küçük miktarda ısı.
entalpi
Daha fazlası için geniş uygulama termodinamiğin birinci yasası entalpi kavramını tanıtır.
Bu, bir maddenin toplam enerjisinin toplam miktarının ve hacim ile basıncın çarpımının adıdır. Entalpinin fiziksel ifadesi aşağıdaki formülle temsil edilebilir:
Entalpinin mutlak değeri, sistemi oluşturan tüm parçaların entalpilerinin toplamıdır.

Kantitatif olarak bu değer belirlenemez. Fizikçiler yalnızca sistemin son ve ilk durumlarının entalpileri arasındaki fark üzerinde çalışırlar. Gerçekten de, sistemin durumundaki değişikliğin herhangi bir hesaplamasında, potansiyel enerjinin sıfıra eşit olduğu belirli bir seviye seçilir. Aynısı entalpi hesaplanırken de yapılır. Entalpi kavramını uygularsak, izoprosesler için termodinamiğin birinci yasası şöyle görünecektir: dU = dW- dH
Herhangi bir sistemin entalpisi şunlara bağlıdır: iç yapı Bu sistemi oluşturan maddeler. Bu göstergeler, sırayla, maddenin yapısına, sıcaklığına, miktarına ve basıncına bağlıdır. İçin karmaşık maddeler Basit bileşenlerden bir mol madde oluşturmak için gereken ısı miktarına eşit olan standart oluşum entalpisini hesaplayabilirsiniz. Kural olarak, standart entalpinin değeri negatiftir, çünkü çoğu durumda karmaşık maddelerin sentezinde ısı açığa çıkar.
Adyabatik süreçlerde termodinamiğin birinci yasası
Termodinamiğin birinci yasasının izoproseslere uygulanması grafiksel olarak görüntülenebilir. Örneğin, ısı miktarının tüm zaman boyunca değişmeden kaldığı adyabatik bir süreç düşünün. Q= const. Böyle bir izoproses, termal olarak yalıtılmış sistemlerde veya sistemin dış ortam ile ısı alışverişi yapmak için zamanı olmayacak kadar kısa bir sürede gerçekleşir. Hacim-basınç diyagramında bir gazın yavaş genleşmesi aşağıdaki eğri ile tanımlanır:

Grafiğe göre, termodinamiğin birinci yasasının izoproseslere uygulanması haklı gösterilebilir. Adyabatik süreçte ısı miktarında bir değişiklik olmadığı için iç enerjideki değişiklik yapılan iş miktarına eşittir. dU= - dW
Böylece sistemin iç enerjisi azalır ve sıcaklığı düşer.
Adyabatik süreç örnekleri
Tersi ifade de doğrudur: ısı değişiminin yokluğunda basınçtaki bir azalma, sistemin sıcaklığını keskin bir şekilde artırır. Bu yaklaşık olarak içten yanmalı motorlarda gazın nasıl genişlediğidir. Dizel motorlarda yanıcı gaz 15 kez sıkıştırılır. Sıcaklıkta kısa süreli bir artış, yanıcı karışımın kendi kendine tutuşmasına izin verir.

Adyabatik sürecin başka bir örneği de düşünülebilir - gazların serbest genleşmesi. Bunu yapmak için, iki konteynerden oluşan böyle bir kurulumu düşünün:

Birinci kapta gaz var, ikincisinde gaz yok. Musluğu çevirerek, gazın kendisine ayrılan hacmin tamamını doldurmasını sağlayacağız. Sistem yeterince yalıtılmışsa, gaz sıcaklığı değişmeden kalacaktır. Gaz herhangi bir iş yapmadığından, değişken dW= const. Diğer her şey eşit olduğunda, genleşme sırasında gaz sıcaklığının düştüğü ortaya çıktı. Gaz genleşmesi eşit değildir, bu nedenle bu süreç basınç-hacim diyagramında gösterilemez.
Termodinamiğin birinci yasası, Evrendeki tüm gözlemlenebilir süreçler için geçerli olan evrensel bir yasadır. Bu veya bu enerji dönüşümlerinin nedenlerinin derinlemesine anlaşılması, mevcut fiziksel fenomenleri anlamanıza ve yeni yasalar keşfetmenize olanak tanır.
Birbirleriyle mekanik ve termal etkileşimleri sırasında cisimlerin özellikleri, aşağıdakilere dayanarak oldukça iyi tanımlanabilir: moleküler kinetik teori... Bu teoriye göre, tüm cisimler sürekli kaotik hareket halinde olan en küçük parçacıklardan - atomlar, moleküller veya iyonlardan oluşur. termal ve birbirleriyle etkileşime geçin. Bu parçacıkların hareketi mekanik yasalarına uyar. Bu tür parçacıkların bir sisteminin durumu, termodinamik parametrelerinin (veya durum parametrelerinin), yani. sistemin makroskopik özelliklerini karakterize eden fiziksel nicelikler. Tipik olarak, durum parametreleri olarak sıcaklık, basınç ve özgül hacim seçilir. İçsel enerji böyle bir sistem, yalnızca termodinamik sistemin durumuna bağlı olan enerji olarak adlandırılır. İçsel enerji Sistem, sistemi oluşturan moleküllerin kinetik enerjisinden, birbirleriyle etkileşimlerinin potansiyel enerjisinden, molekül içi enerjiden (yani, moleküllerdeki atomların veya iyonların etkileşiminin enerjisi, atomların elektron kabuklarının enerjisinden) oluşur. ve iyonlar, intranükleer enerji) ve sistemdeki elektromanyetik radyasyon enerjisi.
Sistem ayrıca sahip olabilir dış enerji, sistemin bir bütün olarak kinetik enerjisinin (sistemin kütle merkezinin kinetik enerjisi) ve sistemin dış kuvvetler alanındaki potansiyel enerjisinin toplamıdır. İç ve dış enerji oluşumu tam Enerji sistemler.
Bununla birlikte, vücudun iç enerjisinin katı bir şekilde hesaplanması zordur. İç enerji ancak termodinamik yöntemlerle bulunamayan sabit bir terimin doğruluğu ile belirlenebilir. Ancak çoğu durumda, yalnızca iç enerji D'deki değişikliklerle ilgilenmek gerekir. sen , mutlak değeri ile değil sen , bu nedenle, iç enerji, çoğu durumda sabit bir terim olarak kabul edilebilecek intramoleküler enerjiden sayılabilir. Çoğu zaman, sıfır iç enerji için ( sen = 0) sistemin sahip olduğu enerjiyi mutlak sıfırda alın (yani T = 0 K).
Vücudun iç enerjisi şu şekilde değiştirilebilir: ısı transferi veya mekanik darbe, yani. vücut üzerinde üreten İş... Bazı durumlarda ısı değişimi ve mekanik hareket, vücudun iç enerjisinde aynı değişikliklere yol açabilir. Bu, ısı ve işi karşılaştırmayı ve bunları aynı birimde ölçmeyi mümkün kılar. Sıcaklık temas halindeyken veya ısıtılmış bir cisimden radyasyon yoluyla bir cisimden diğerine aktarılan enerjiyi temsil eder, yani. özünde, artık makroskopik cisimler tarafından değil, düzensiz hareket eden mikropartiküller tarafından gerçekleştirilen işle uğraşıyoruz. Böylece, bir termodinamik sistem belirli bir miktarda ısı alabilir veya verebilir. dQ , üzerinde çalışma yapılabilir veya üzerinde çalışma yapılabilir. Sistem tarafından veya sistem üzerinden taahhüt İş bir onunla etkileşime giren dış cisimlerin hareketi... Yarı statik, denge süreci durumunda, temel iş dA , vücudun hacmini miktara göre değiştirmek için mükemmel dV , eşittir
Nereye P - baskı yapmak.
bu iş dA aranan genişletme çalışması ve işi temsil eder sistem dış güçlere karşı üretir.
Sistem hacimli bir durumdan geçiş yaptığında tam çalışma 1 hacimli bir duruma V2 eşit olacak
Geometrik anlamından kesin integral bu işi takip eder A , sistem tarafından birinci durumdan ikinci duruma geçiş sırasında gerçekleştirilen, bu işlemi koordinatlarda tanımlayan eğrinin altındaki alana eşit olacaktır. P , V (yani, kavisli bir yamuğun gölgeli alanı, bkz. Şekil 1). Sonuç olarak, iş sadece sistemin ilk ve son durumuna değil, aynı zamanda bir durumdan diğerine geçişin nasıl gerçekleştirildiğine de bağlıdır.

İş, ısı gibi, sürecin nasıl yürütüldüğüne bağlıdır. İç enerji ile birlikte iş ve ısı da enerji formlarıdır. Termodinamikte enerjinin korunumu yasasına denir. termodinamiğin ilk başlangıcı (veya birinci yasası).
Termodinamiğin birinci yasasının pratik kullanımı için, ısı ve iş işaretinin seçiminde anlaşmak gerekir. Isı sisteme iletildiğinde pozitif, sistem dış kuvvetlerin etkisine karşı gerçekleştirdiğinde ise iş pozitif kabul edilecektir.
Termodinamiğin birinci yasası aşağıdaki gibi formüle edilir: sisteme verilen ısı miktarıdQ sistemin iç enerjisini değiştirmek için harcanandU ve işi bitirmekdA bu sistem tarafından dış cisimler üzerinde.
![]() (4)
(4)
İç enerji tam diferansiyel... Sürecin türüne bağlı değildir, sadece sistemin ilk ve son durumu tarafından belirlenir. Döngüsel bir süreçte, iç enerjideki değişim sıfırdır, yani. Q=A .
30. Sıcaklık. Sıcaklık ölçekleri. İdeal bir gazın ısı kapasitesi ve iç enerjisi. Özgül ısı С р ve С v
Sıcaklık, genel olarak fizikte önemli rol oynayan temel kavramlardan biridir.
Sıcaklık- makroskopik bir sistemin termodinamik denge durumunu karakterize eden ve cisimler arasındaki ısı transferinin yönünü belirleyen fiziksel bir miktar.
Termodinamikte sıcaklık kavramı, aşağıdaki hükümler temelinde tanıtıldı:
1. A ve B cisimleri termal temas halindeyse ve A cisiminden B cismine ısı geçiyorsa, A cismi daha yüksektir.
2. A cisiminden B cismine ısı aktarılmazsa ve bunun tersi de, A ve B cisimlerinin sıcaklığı aynıdır.
3. Vücut sıcaklığı A, vücut sıcaklığı C'ye ve vücut sıcaklığı B vücut sıcaklığı C'ye eşitse, A ve B vücutları da aynı sıcaklığa sahiptir.
Gazların moleküler kinetik teorisinde, sıcaklığın, moleküllerin öteleme hareketinin ortalama kinetik enerjisinin bir ölçüsü olduğu gösterilmiştir.
Sıcaklık ile ölçülür termometrik cisimler(herhangi bir parametresi sıcaklığa bağlıdır).
Şu anda kullan iki sıcaklık ölçeği.
Uluslararası Pratik Ölçek (Celsius ölçeği), Santigrat derece (° C) olarak ikişer derece ile derecelendirilmiştir. referans noktaları - sırasıyla 0 ° C ve 100 ° C olarak alınan 1.013 · 10 5 Pa basınçta suyun donma ve kaynama sıcaklıkları.
Termodinamik sıcaklık ölçeği (Kelvin ölçeği), derece Kelvin (K) olarak derecelendirilir, bir referans noktası ile belirlenir - üçlü su noktası - buz, su ve doymuş buhar 609 Pa basınçta termodinamik dengededir. Bu noktanın bu ölçekteki sıcaklığı 273.16 K'dır. Sıcaklık T =0 K aranan sıfır Kelvin .
Termodinamik sıcaklık ( T) ve sıcaklık ( T) Santigrat ölçeğinde oran ile ilişkilidir T=273,15+T
Farklı cisimler, farklı miktarlarda ısı sağlayarak aynı sıcaklığa ısıtılabilir. Demek oluyor çeşitli maddelerısıya karşı farklı hassasiyetleri vardır.
Bu duyarlılık, adı verilen bir miktar ile karakterize edilir. ısı kapasitesi.
Bir vücuttan diğerine iki tür enerji aktarımı vardır - bu, bazı cisimlerin çalışmalarının diğerleri üzerindeki performansı ve ısı aktarımıdır. Enerji mekanik hareket termal hareket enerjisine dönüştürülebilir ve bunun tersi de mümkündür. Bu tür enerji geçişlerinde, enerjinin korunumu yasası yerine getirilir. Termodinamikte ele alınan süreçlere uygulandığında, enerjinin korunumu yasasına termodinamiğin birinci yasası (veya birinci yasası) denir. Bu yasa, ampirik verilerin bir genellemesidir.
Termodinamiğin birinci yasasının formülasyonu
Termodinamiğin birinci yasası şu şekilde formüle edilir:
Sisteme verilen ısı miktarı, bu sistemin performansına (dış kuvvetlere karşı) ve iç enerjisinin değiştirilmesine harcanır. Matematiksel formda, termodinamiğin birinci yasası integral formda yazılabilir:
termodinamik sistem tarafından alınan ısı miktarı nerede; - incelenen sistemin iç enerjisindeki değişiklik; A, sistemin dış cisimler üzerinde (dış kuvvetlere karşı) yaptığı iştir.
Diferansiyel formda, termodinamiğin birinci yasası şu şekilde yazılır:
sistemin aldığı ısı miktarının elemanı nerede; - Sonsuza kadar küçük iş termodinamik sistem tarafından gerçekleştirilen; - incelenen sistemin iç enerjisinde temel bir değişiklik. Formül (2)'de - iç enerjideki temel bir değişikliğin ve'nin aksine tam bir diferansiyel olduğu belirtilmelidir.
Sistem ısı alırsa ısı miktarı pozitif, termodinamik sistemden ısı çıkarılırsa negatif olarak kabul edilir. Sistem yapıyorsa iş sıfırdan büyük olacak ve sistem üzerinde dış kuvvetler tarafından gerçekleştirilirse iş negatif olarak kabul edilecektir.
Sistemin orijinal durumuna dönmesi durumunda, iç enerjisindeki değişim sıfıra eşit olacaktır:
Bu durumda termodinamiğin birinci yasasına göre:
(4) numaralı ifade, birinci türden bir sürekli hareket makinesinin imkansız olduğu anlamına gelir. Yani prensipte, sistemin dışarıdan aldığı ısı miktarından daha fazla iş yapan periyodik olarak çalışan bir sistem (ısı motoru) oluşturmak imkansızdır. Birinci türden bir sürekli hareket makinesinin imkansızlığının konumu da termodinamiğin birinci yasasını formüle etmek için seçeneklerden biridir.
Problem çözme örnekleri
ÖRNEK 1
| Egzersiz yapmak | İzokorik ısıtma sırasında basıncı değişirse, V hacmine sahip bir ideal gaza ne miktarda ısı () aktarılır? Bir gaz molekülünün serbestlik derecesi sayısının i'ye eşit olduğunu düşünün. |
| Çözüm | Problemi çözmenin temeli, integral formda kullanacağımız termodinamiğin birinci yasasıdır: Sorunun durumuna göre, gazla işlem izokorik () yapıldığından, bu işlemdeki iş sıfırdır, o zaman izokorik işlem için termodinamiğin birinci yasası şu şekilde olacaktır: İç enerjideki değişim aşağıdaki formül kullanılarak belirlenir:
burada i, bir gaz molekülünün serbestlik derecesi sayısıdır; - madde miktarı; R evrensel gaz sabitidir. Söz konusu süreçte gaz sıcaklığının nasıl değiştiğini bilmediğimiz için, aşağıdakileri bulmak için Mendeleev - Clapeyron denklemini kullanırız: (1.4)'den sıcaklığı ifade edelim, söz konusu sistemin iki durumu için formülleri yazalım: İfadeleri (1.5) kullanarak şunları buluruz: (1.3) ve (1.6) ifadelerinden izokorik bir süreç için iç enerjideki değişim şu şekilde bulunabilir: Ve sürecimiz için termodinamiğin birinci yasasından (at), şuna sahibiz:
|
| Cevap |
ÖRNEK 2
| Egzersiz yapmak | Oksijenin iç enerjisindeki değişimi (), yaptığı işi (A) ve işlem sırasında alınan ısı miktarını () grafikte gösterilen (1-2-3) bulun (Şekil 1) . m 3'ü düşünün; 100 kPa; m3; kPa. |
| Çözüm | İç enerji, durumun bir fonksiyonu olduğundan, iç enerjideki değişim sürecin gidişatına bağlı değildir. Sadece sistemin son ve başlangıç durumlarına bağlıdır. Bu nedenle, 1-2-3 sürecinde iç enerjideki değişimin şuna eşit olduğunu yazabiliriz:
burada i oksijen molekülünün serbestlik derecesi sayısıdır (molekül iki atomdan oluştuğu için sayarız), madde miktarıdır. Sıcaklık farkı, ideal gaz hal denklemi kullanılarak ve proses grafiğine bakılarak bulunabilir: |
| Okumak: |
|---|
Popüler:
Yeni
- İngilizce Londra Simgeleri: açıklama ve fotoğraflar Nesneyi tanımlamak için özellikler
- Toplama kuralları
- Temel Selamlaşma Biçimleri (Nihao Çeviri)
- Öbek fiil TURN, ifadeler ve deyimler
- BelZhD'nin çevrimiçi bir puan tablosu var
- ivme nedir? Hız. hızlanma Eğer vücut hızlanırsa
- Word'deki menü şablonları: indirin ve yazdırın
- Bayes teoreminin basit matematiği
- Pearson korelasyon kriteri Korelasyon katsayısı 1 ortalama
- Bulanık ve rastgele kümeler Önerme cebirinin temel denklikleri








 pV = RT,
pV = RT,





 ;
;

 ,
,








 Sabit bir hacimde bir molün ısı kapasitesi (v=
const).
Sabit bir hacimde bir molün ısı kapasitesi (v=
const).
 [
]
;
[
]
;


 ;
;






 piston alanı başına
piston alanı başına  eşittir
eşittir  ... Pistonu hareket ettirirken yapılan iş
... Pistonu hareket ettirirken yapılan iş  , eşittir
, eşittir  , nerede
, nerede  gaz hacmindeki değişiklik (Şekil 14.1), yani
gaz hacmindeki değişiklik (Şekil 14.1), yani 

 ve
ve  iç enerjinin ilk ve son değerleri;
iç enerjinin ilk ve son değerleri; sistemin dış cisimler üzerinde yaptığı iş.
sistemin dış cisimler üzerinde yaptığı iş.
 iç enerjideki değişim;
iç enerjideki değişim; vücut tarafından yapılan iş (örneğin, bir gazı genişletirken yapılan iş).
vücut tarafından yapılan iş (örneğin, bir gazı genişletirken yapılan iş). vücut vücuda verilen ısı miktarının oranına eşit değere denir
vücut vücuda verilen ısı miktarının oranına eşit değere denir  karşılık gelen sıcaklık artışına
karşılık gelen sıcaklık artışına  .
.

 ) ve maddenin birim kütlesi için
) ve maddenin birim kütlesi için  .
.
 tanım gereği ve aşağıdakileri içeren bir süreç için:
tanım gereği ve aşağıdakileri içeren bir süreç için: , nerede
, nerede sabit hacimde gazın ısı kapasitesi.
sabit hacimde gazın ısı kapasitesi. ve
ve
 .
.
 , 1 mol alırız
, 1 mol alırız 
 .
.

 eksene paralel düz bir çizgi olarak gösterilen
eksene paralel düz bir çizgi olarak gösterilen  (şek.14.2). İzobarik süreçte, hacmin genişlemesi sırasında gazın çalışması
(şek.14.2). İzobarik süreçte, hacmin genişlemesi sırasında gazın çalışması  önce
önce  eşittir:
eşittir: 

 .
.


 .
. ,
,  , (sıcaklık düşer). Gaz sıkıştırılmış olsaydı
, (sıcaklık düşer). Gaz sıkıştırılmış olsaydı  , sonra
, sonra  (sıcaklık yükselir). Adyabatik süreçte gazın parametreleriyle ilgili bir denklem türetelim. İdeal gaz için bunu dikkate alalım
(sıcaklık yükselir). Adyabatik süreçte gazın parametreleriyle ilgili bir denklem türetelim. İdeal gaz için bunu dikkate alalım  , sonra
, sonra
 :
: .
.
 , sonra
, sonra .
.
 .
. .
.


 :
: ,
,
 , o zaman adyabatik arsa izotermden daha diktir. hadi hesaplayalım adyabatik çalışma:
, o zaman adyabatik arsa izotermden daha diktir. hadi hesaplayalım adyabatik çalışma:

 forma sahip
forma sahip